Содержание
- 2. Мета. Порівняти склад оксидів сульфуру, нітрогену, фосфору, карбону і силіцію їх фізичні та хімічні властивості. Узагальнити
- 3. Неметали утворюють два класи кисневмісних сполук − оксиди і гідроксиди.
- 4. Будова сполук. Майже всі оксиди неметалічних елементів складаються з молекул. У них ковалентні зв’язки між атомами
- 5. Оксиди неметалічних елементів. Мають кислотний характер Більшість із них розчиняється у воді з утворенням відповідних кислот,
- 8. Кислотні властивості вищих оксидів неметалічних елементів у кожному періоді посилюються зліва направо
- 9. У такому самому напрямку збільшується і сила відповідних кислот. Наприклад, оксид SiO2 не взаємодіє з водою,
- 10. Допишіть схеми реакцій і складіть хімічні рівняння: SO2 + O2→ CO2 + MgO → CO2 +
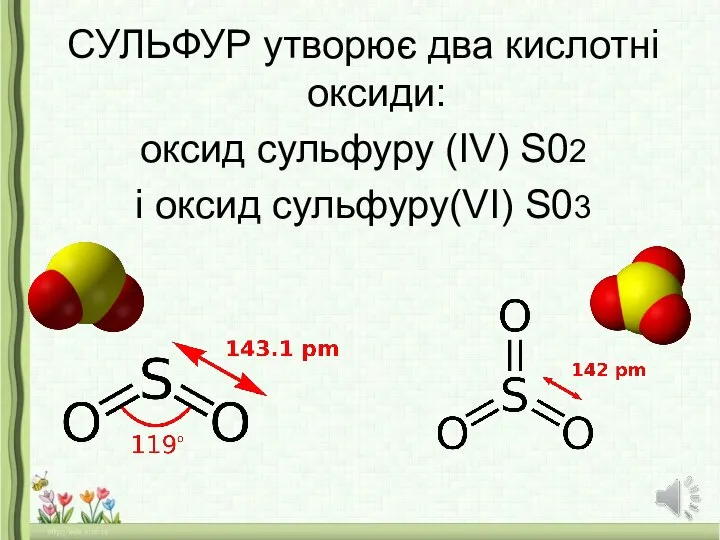
- 11. СУЛЬФУР утворює два кислотні оксиди: оксид сульфуру (ІV) S02 і оксид сульфуру(VI) S03
- 13. Оксид сульфуру(IV) SO2 (діоксид сульфуру, сірчистий газ) — це безбарвний важкий газ (у 2,2 раза важчий
- 14. Він є у вулканічних газах і серед газоподібних продуктів горіння палива, у якому завжди містяться домішки
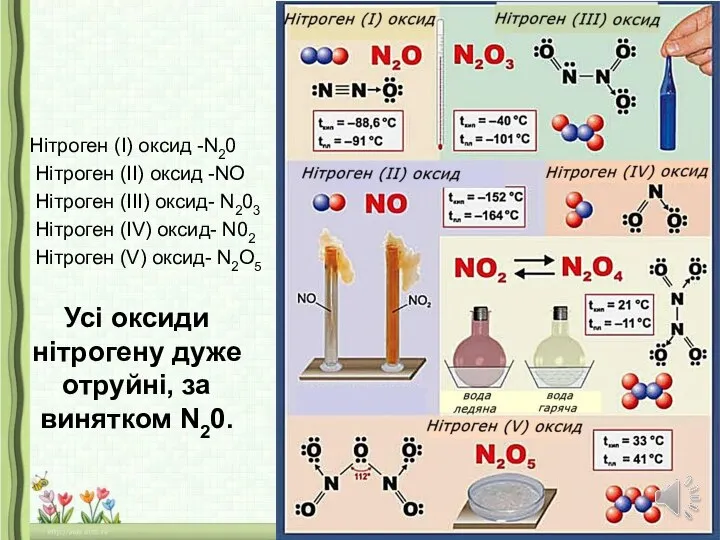
- 15. НІТРОГЕН З ОКСИГЕНОМ утворює п'ять оксидів, в яких він виявляє ступінь окиснення від +1 до +5:
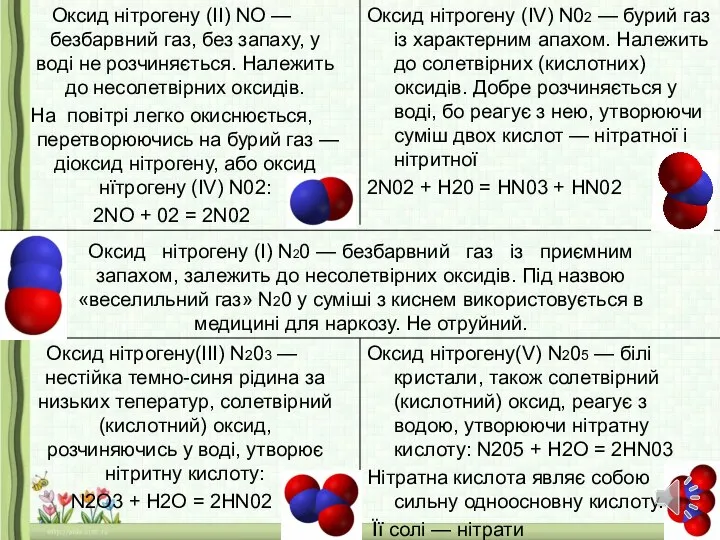
- 16. Усі оксиди нітрогену дуже отруйні, за винятком N20. Нітроген (I) оксид -N20 Нітроген (II) оксид -NO
- 17. Оксид нітрогену (І) N20 — безбарвний газ із приємним запахом, залежить до несолетвірних оксидів. Під назвою
- 18. 2NO2 + H2O= HNO3 + НNO2
- 19. Найбільше забруднення повітря нітроген(ІV) оксидом спричиняють автомобілі — під час згорання пального в циліндрах двигунів утворюється
- 20. З оксидів фосфору Р205 і Р203 найбільше значення має оксид фосфору(V).
- 21. Оксид фосфору (V) Р205 — білий дрібнокристалічний порошок, дуже гігроскопічний, тому застосовується для осушування газів. Типовий
- 22. ЕЛЕМЕНТ КАРБОН З ЕЛЕМЕНТОМ ОКСИГЕНОМ утворює два оксиди — С02 і СО. С02 — оксид карбону(IV),
- 23. Будова
- 24. Оксид карбону(IV), або вуглекислий газ, С02 за звичайних умов — безбарвний газ, без запаху, важчий за
- 26. Взаємодія з водою. Якщо у пробірку з водою (1 — 2 мл) додати 1—2 краплі розчину
- 27. Добування оксиду карбону(ІУ). У лабораторних умовах С02 добувають дією хлоридної кислоти на мармур: СаС03 + 2НСl
- 28. Застосовується діоксид карбону у виробництві соди за аміачно-хлоридним способом , для синтезу карбаміду, добування солей карбонатної
- 30. Наслідки парникового ефекту
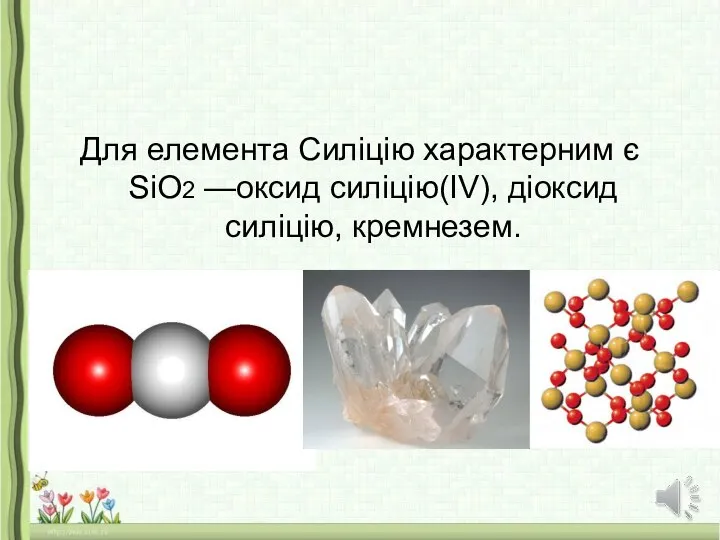
- 31. Для елемента Силіцію характерним є SiO2 —оксид силіцію(IV), діоксид силіцію, кремнезем.
- 32. Оксид силіцію(ІV) SiO2, або діоксид силіцію, — тверда речовина, кристалічна, безбарвна, тугоплавка (tпл. 1728 °С), у
- 34. Оксид силіцію (IV) Si02 взаємодіє з твердими лугами та основними оксидами під час сплавляння, утворюючи солі
- 35. Зважаючи на те, що солетвірні оксиди неметалічних елементів належать до кислотних оксидів, їх гідратними формами є
- 37. Скачать презентацию






























 Химические свойства металлов
Химические свойства металлов  Аттестационная работа. Программа элективного курса по химии экологическая химия
Аттестационная работа. Программа элективного курса по химии экологическая химия Общая характеристика элементов VII А группы
Общая характеристика элементов VII А группы Кинетика межфазного распределения радионуклидов
Кинетика межфазного распределения радионуклидов Презентация по химии ВВЕДЕНИЕ В ЭКОЛОГИЧЕСКУЮ ХИМИЮ АНТРОПОГЕННОЕ ЗАГРЯЗНЕНИЕ ПРИРОДНОЙ СРЕДЫ ФАРМПОЛЛЮТАНТЫ
Презентация по химии ВВЕДЕНИЕ В ЭКОЛОГИЧЕСКУЮ ХИМИЮ АНТРОПОГЕННОЕ ЗАГРЯЗНЕНИЕ ПРИРОДНОЙ СРЕДЫ ФАРМПОЛЛЮТАНТЫ  Йод
Йод Отчет по производственной практике. Место производственной практики ФГБОУ ВО «Пермской ГСХА», кафедра агрохимии
Отчет по производственной практике. Место производственной практики ФГБОУ ВО «Пермской ГСХА», кафедра агрохимии Основы строения органических соединений
Основы строения органических соединений Презентация по Химии "Классификация углеводов" - скачать смотреть
Презентация по Химии "Классификация углеводов" - скачать смотреть  Лекция № 20 Тема: Окислительно-восстановительные равновесия в аналитической химии
Лекция № 20 Тема: Окислительно-восстановительные равновесия в аналитической химии Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Спирты
Спирты Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений IV,III группа периодической системы Д..И. Менделеева. Кислота борная, натрия гидрокарбонат
IV,III группа периодической системы Д..И. Менделеева. Кислота борная, натрия гидрокарбонат Тема: Понятие об углеводах. Моносахариды. Химические свойства глюкозы
Тема: Понятие об углеводах. Моносахариды. Химические свойства глюкозы Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Амины. Номенклатура аминов
Амины. Номенклатура аминов Тепловой эффект сгорания топлива
Тепловой эффект сгорания топлива Химиялык кару
Химиялык кару Вещества и их свойства
Вещества и их свойства Арены. 10 класс
Арены. 10 класс Заполни электронные уровни элементов
Заполни электронные уровни элементов Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша)
Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша) Химические чистящие средства
Химические чистящие средства Липиды. Общая характеристика липидов
Липиды. Общая характеристика липидов Роботу виконав: Желєзний Влад
Роботу виконав: Желєзний Влад  Молекулярные свойства жидкостей
Молекулярные свойства жидкостей Metals
Metals