Содержание
- 2. Е = ϕправ. − ϕлев. = ϕα' − ϕα = (ϕα'−ϕδ) + (ϕδ−ϕγ) + (ϕγ−ϕβ) +
- 4. Окислительно-восстановительные реакции – химические реакции с переносом электрона. Поскольку электроны не появляются и не исчезают, их
- 5. Cl2 + H2 = 2 HCl Стандартный водородный электрод: Pt(H2, p=1 атм.) | HCl (α =
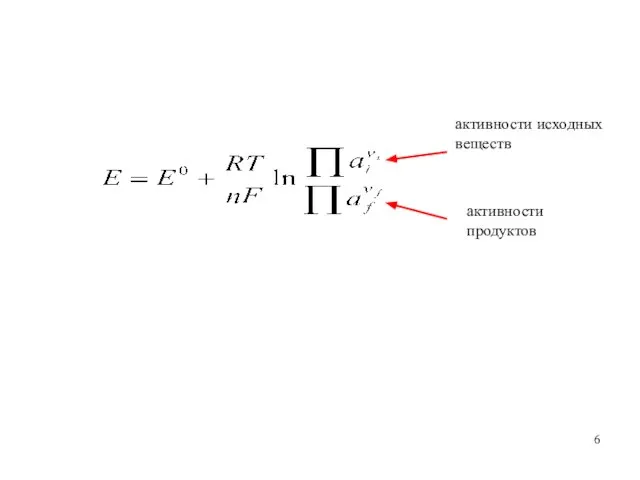
- 6. активности исходных веществ активности продуктов
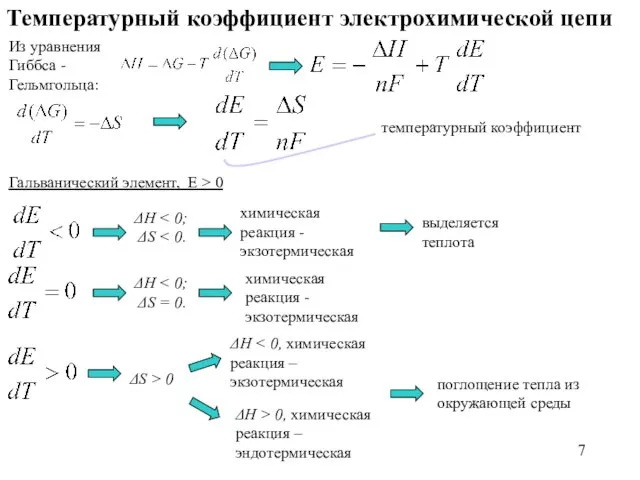
- 7. Температурный коэффициент электрохимической цепи Из уравнения Гиббса - Гельмгольца: температурный коэффициент Гальванический элемент, E > 0
- 8. Схема записи ГЦ ГЦ без переноса Pt Ag AgCl HCl Pt(Cl2) Pt ГЦ с переносом Pt(H2)
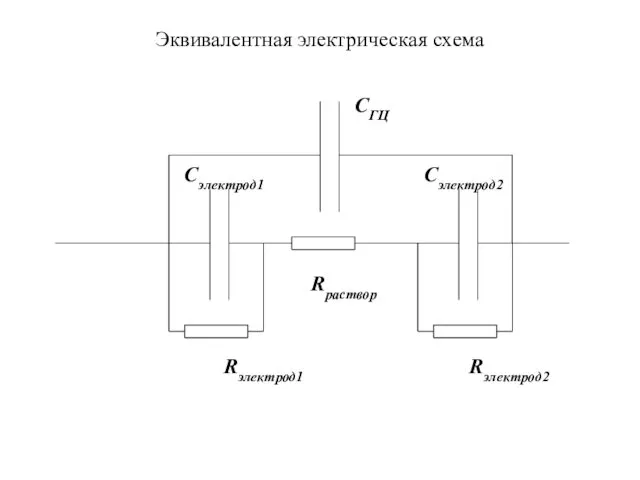
- 9. Эквивалентная электрическая схема
- 10. Измерение ЭДС ГЦ в равновесных условиях а) компенсационный метод или метод Поггендорфа Стандарты ЭДС. Элемент Вестона:
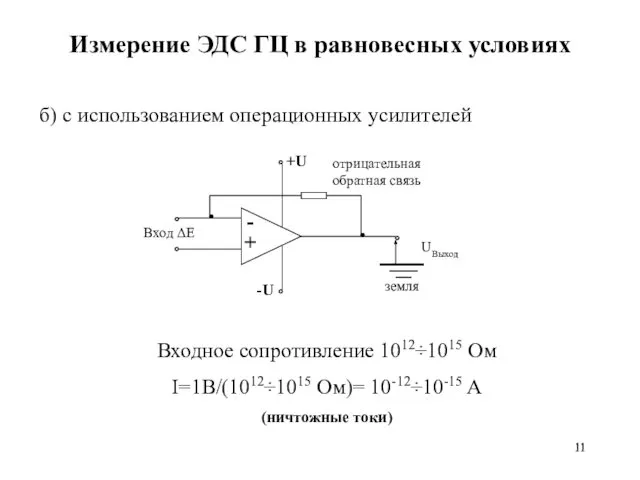
- 11. Измерение ЭДС ГЦ в равновесных условиях б) с использованием операционных усилителей Входное сопротивление 1012÷1015 Ом I=1B/(1012÷1015
- 12. Mz+ + ne → M0 потенциал зависит от активности иона металла Амальгамные – потенциал также зависит
- 13. Труднорастворимая соль (оксид) анион соли (ионы OH-) + металл Классификация электродов. Электрод 2 рода Электрод 2
- 14. Классификация электродов. Электрод 3 рода Электрод 3 рода. Металл в контакте с двумя труднорастворимыми солями. Ag
- 15. Классификация электродов Окислительно-восстановительные электроды. Окисленная и восстановленная формы – в растворе. Материал электрода не участвует в
- 16. Классификация электродов Окисленной или восстановленной формой является молекула в газовой фазе, диссоциативно адсорбирующаяся на инертном электроде.
- 17. Ионоселективные электроды
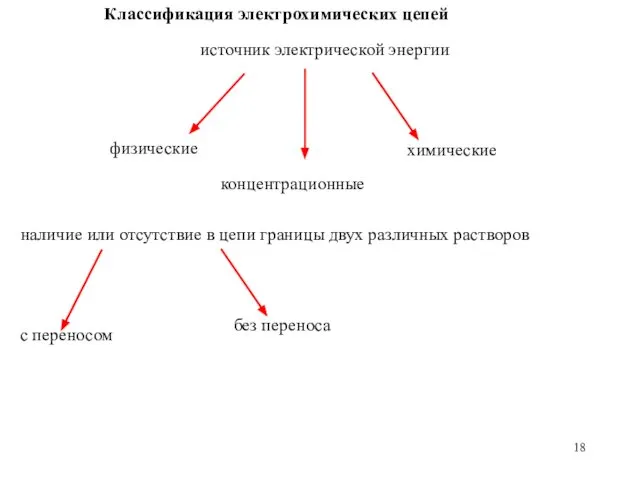
- 18. Классификация электрохимических цепей источник электрической энергии физические концентрационные химические наличие или отсутствие в цепи границы двух
- 19. Физические, концентрационные цепи Физические цепи (без переноса): аллотропические и гравитационные: источник электрической энергии – различие в
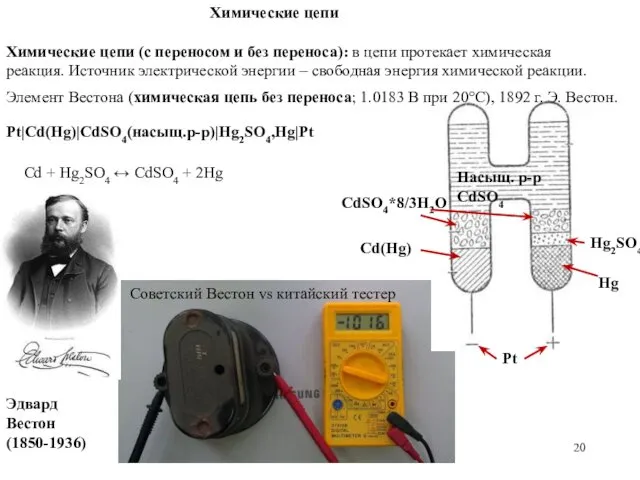
- 20. Hg2SO4 Pt|Cd(Hg)|CdSO4(насыщ.р-р)|Hg2SO4,Hg|Pt Химические цепи Химические цепи (с переносом и без переноса): в цепи протекает химическая реакция.
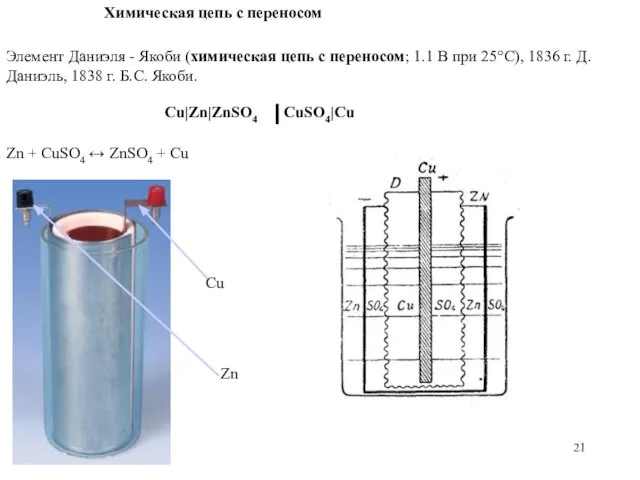
- 21. Химическая цепь с переносом Элемент Даниэля - Якоби (химическая цепь с переносом; 1.1 В при 25°С),
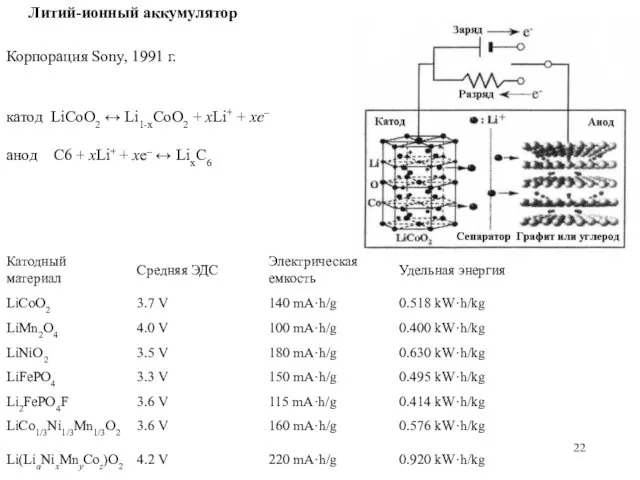
- 22. Литий-ионный аккумулятор Корпорация Sony, 1991 г. катод LiCoO2 ↔ Li1-xCoO2 + xLi+ + xe– анод C6
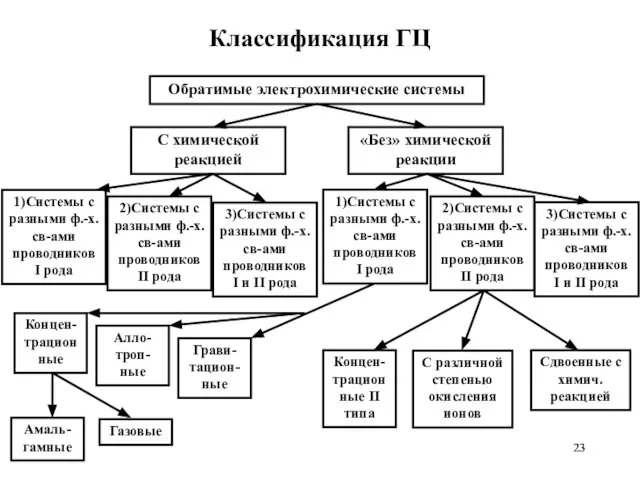
- 23. Классификация ГЦ
- 24. Системы с химической реакцией 1) Системы с разными ф.-х. свойствами проводников I рода Cu| CuCl2(aq) C1||
- 25. Системы с химической реакцией 3) Системы с разными ф.-х. св-ами проводников I и II рода Cd
- 26. Системы «без» химической реакции 1) Системы с разными ф.-х. св-вами проводников I рода Концентрационные I типа
- 28. Скачать презентацию
















 Нефть и способы её переработки
Нефть и способы её переработки Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли
Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли Закономерности протекания химических реакций. Основы химической термодинамики. Лекция 6
Закономерности протекания химических реакций. Основы химической термодинамики. Лекция 6 Соединения кремния Силикатная промышленность.
Соединения кремния Силикатная промышленность. Минералы. Галенит
Минералы. Галенит Биохимия, наука о химических основах жизнедеятельности
Биохимия, наука о химических основах жизнедеятельности Сложные эфиры
Сложные эфиры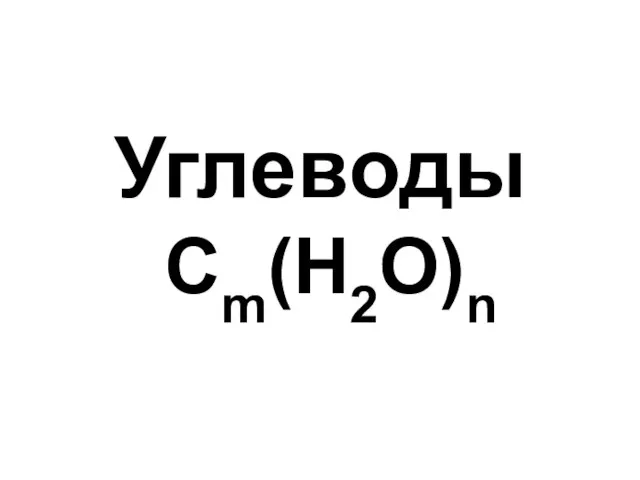 Углеводы. Моносахариды
Углеводы. Моносахариды Добування кисню та вивчення його властивостей
Добування кисню та вивчення його властивостей Химия ғажайыптар әлемі
Химия ғажайыптар әлемі Классификация органических соединений Химия. 10 класс
Классификация органических соединений Химия. 10 класс Типы первичных химических источников тока
Типы первичных химических источников тока Основы химической термодинамики
Основы химической термодинамики Мир стекла
Мир стекла МОУ «Средняя общеобразовательная школа с.3-я Александровка Калининского района Саратовской области» Презентация по химии «Мета
МОУ «Средняя общеобразовательная школа с.3-я Александровка Калининского района Саратовской области» Презентация по химии «Мета Підготував: учень 10-Б класу Федоренко Роман
Підготував: учень 10-Б класу Федоренко Роман  Тема урока : Скорость химической реакции
Тема урока : Скорость химической реакции  Получение меламина из карбамида
Получение меламина из карбамида Азотная кислота и ее свойства
Азотная кислота и ее свойства Органические загрязнители вод
Органические загрязнители вод Периодический закон и строение атома
Периодический закон и строение атома Вода: фізичні та хімічні властивості. Поширеність в природі
Вода: фізичні та хімічні властивості. Поширеність в природі Хлористый водород
Хлористый водород Коррозия металлов
Коррозия металлов Полимерные материалы и изделия
Полимерные материалы и изделия Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Презентация по Химии "Чипсы - вред или польза?" - скачать смотреть
Презентация по Химии "Чипсы - вред или польза?" - скачать смотреть  Тема урока: Составление химических формул бинарных соединений по степени окисления атомов
Тема урока: Составление химических формул бинарных соединений по степени окисления атомов