Содержание
- 2. Структура и содержание опросника ЭГРИ Опросник состоит из 23 пунктов, сгруппированных в 6 разделов. В каждом
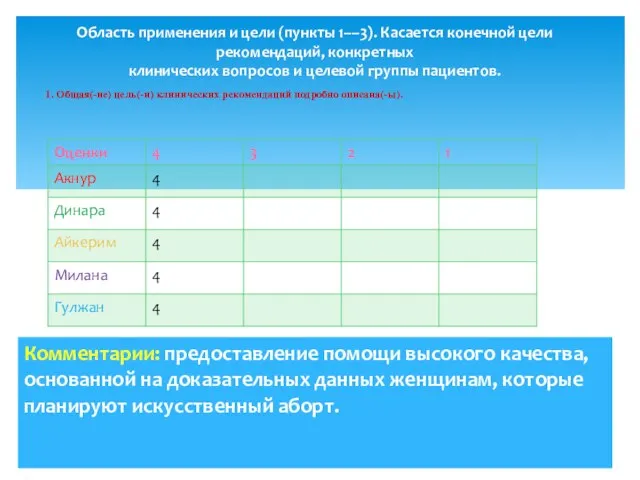
- 3. 1. Общая(-ие) цель(-и) клинических рекомендаций подробно описана(-ы). Область применения и цели (пункты 1––3). Касается конечной цели
- 4. 2. Клинический(-ие) вопрос(-ы), рассматриваемый(-е) в клинических рекомендациях,подробно описан(-ы).
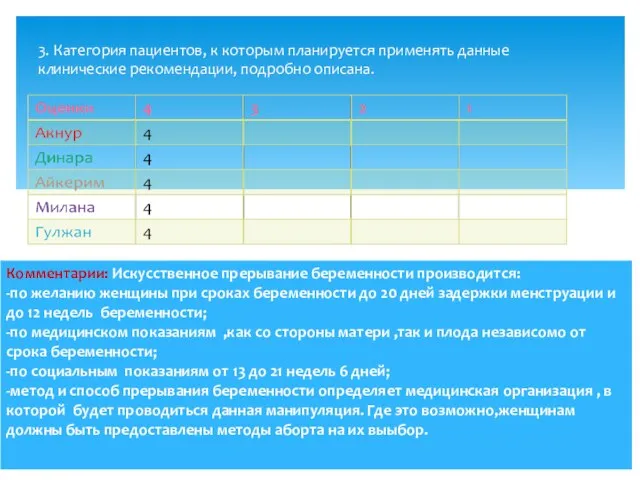
- 5. 3. Категория пациентов, к которым планируется применять данные клинические рекомендации, подробно описана.
- 6. Участие заинтересованных сторон (пункты 4–7). Оценивает степень того, насколько взгляды предполагаемых пользователей учтены в рекомендациях.
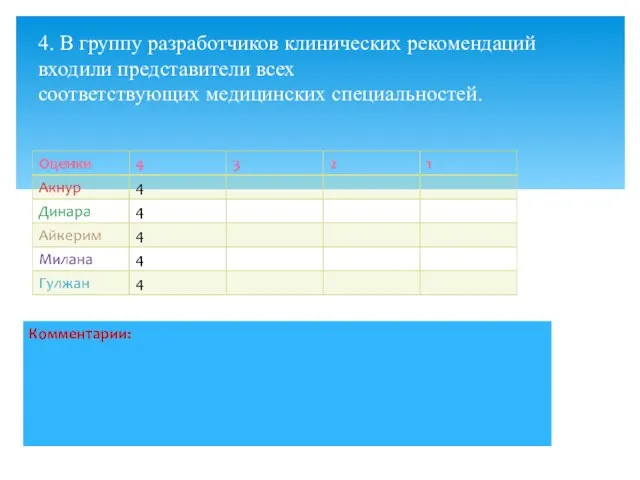
- 7. 4. В группу разработчиков клинических рекомендаций входили представители всех соответствующих медицинских специальностей.
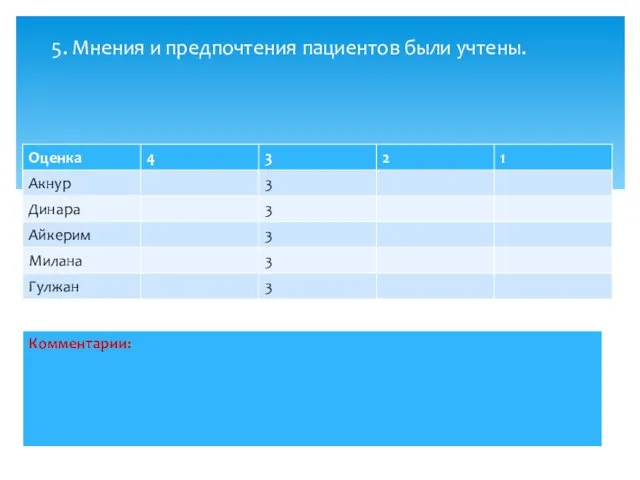
- 8. 5. Мнения и предпочтения пациентов были учтены.
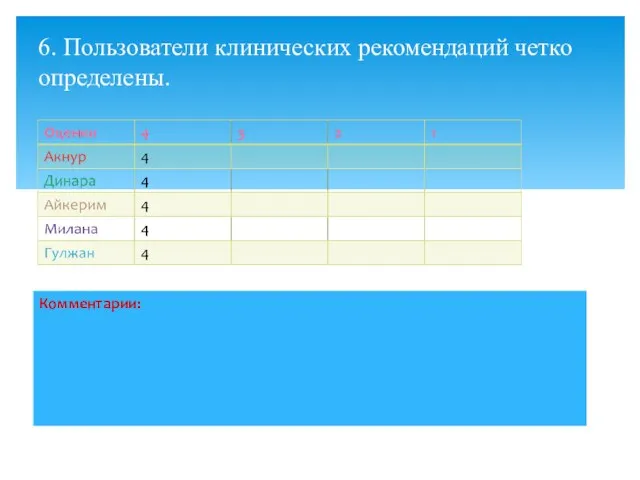
- 9. 6. Пользователи клинических рекомендаций четко определены.
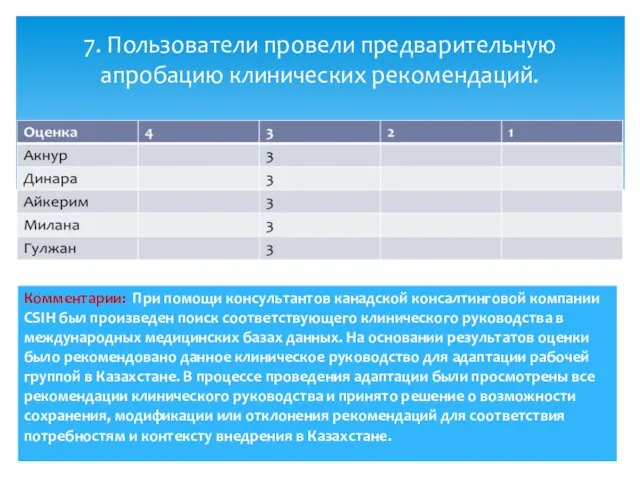
- 10. 7. Пользователи провели предварительную апробацию клинических рекомендаций.
- 11. Тщательность разработки (пункты 8––14). Относится к процессу, применяемому для сбора и синтеза доказательств, методам составления и
- 12. 8.Для поиска доказательств использовались систематические подходы. Комментарии: При разработке более ранних версий этого руководства, были проведены
- 13. Комментарии: 9. Критерии отбора доказательств четко описаны
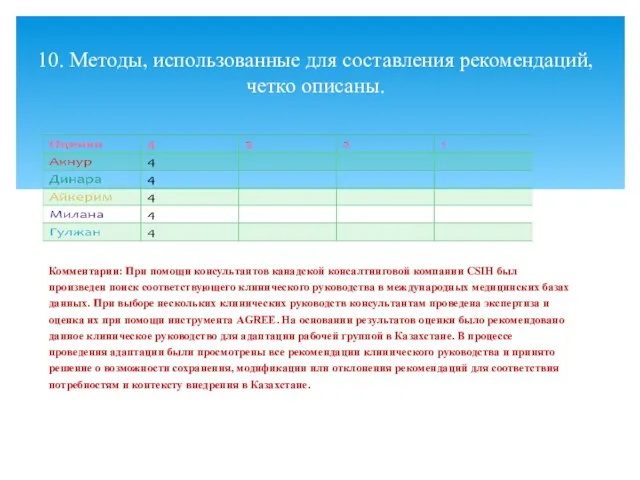
- 14. Комментарии: При помощи консультантов канадской консалтинговой компании CSIH был произведен поиск соответствующего клинического руководства в международных
- 15. Комментарии: 11. Эффективность и безопасность предлагаемых подходов учитывались при составлении рекомендаций.
- 16. Комментарии: 12. Имеется явная связь между рекомендациями и подкрепляющими доказательствами.
- 17. Комментарии: 13. До опубликования клинических рекомендаций проводилось внешнее рецензирование.
- 18. Комментарии: 14. Описан процесс обновления клинических рекомендаций.
- 19. Ясность изложения и форма представления (пункты 15––18). Касается языка и формата рекомендаций.
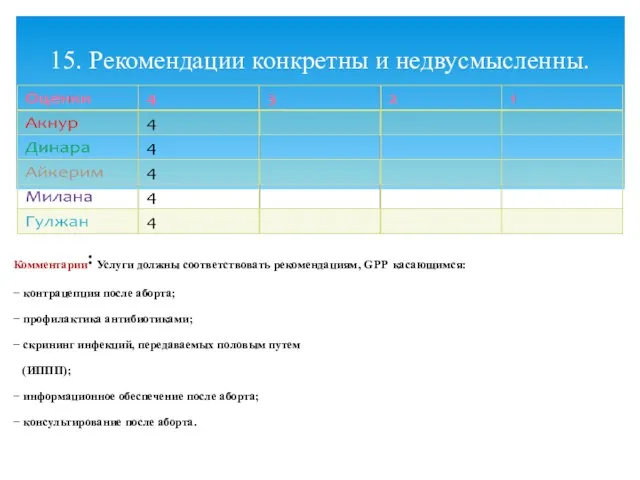
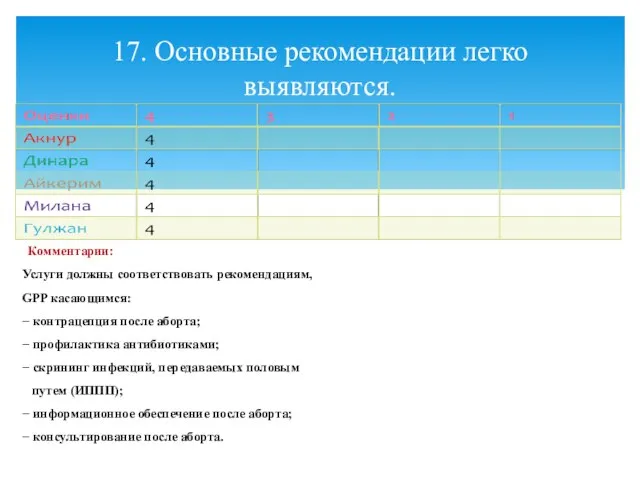
- 20. Комментарии: Услуги должны соответствовать рекомендациям, GPP касающимся: − контрацепция после аборта; − профилактика антибиотиками; − скрининг
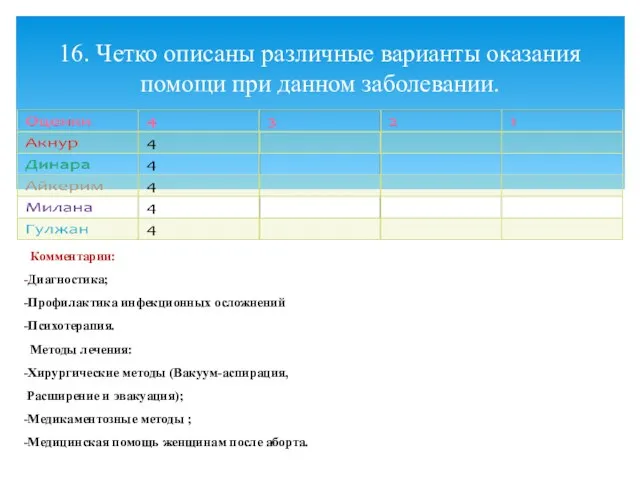
- 21. Комментарии: -Диагностика; -Профилактика инфекционных осложнений -Психотерапия. Методы лечения: -Хирургические методы (Вакуум-аспирация, Расширение и эвакуация); -Медикаментозные методы
- 22. Комментарии: Услуги должны соответствовать рекомендациям, GPP касающимся: − контрацепция после аборта; − профилактика антибиотиками; − скрининг
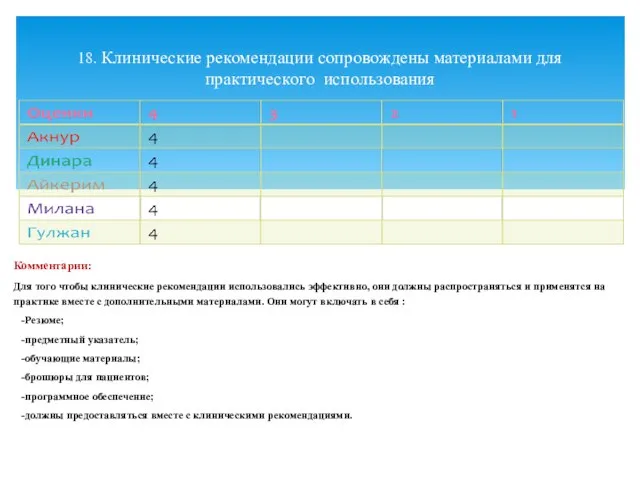
- 23. Комментарии: Для того чтобы клинические рекомендации использовались эффективно, они должны распространяться и применятся на практике вместе
- 24. Возможность внедрения(пункты19-21).Относится к оценке возможных организационных, поведенческих и финансовых последствий внедрения клинических рекомендаций.
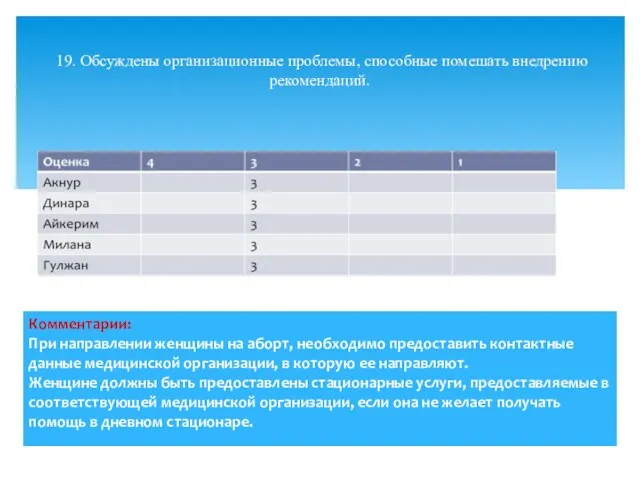
- 25. 19. Обсуждены организационные проблемы, способные помешать внедрению рекомендаций.
- 26. Комментарии: 20. Рассмотрены возможные финансовые последствия внедрения рекомендаций.
- 27. Комментарии: 21. В клинических рекомендациях представлены основные критерии оценки для целей мониторинга и/или аудита
- 28. Независимость разработчиков (пункты 22––23). Касается независимости рекомендаций и признание возможного конфликта интересов их разработчиков.
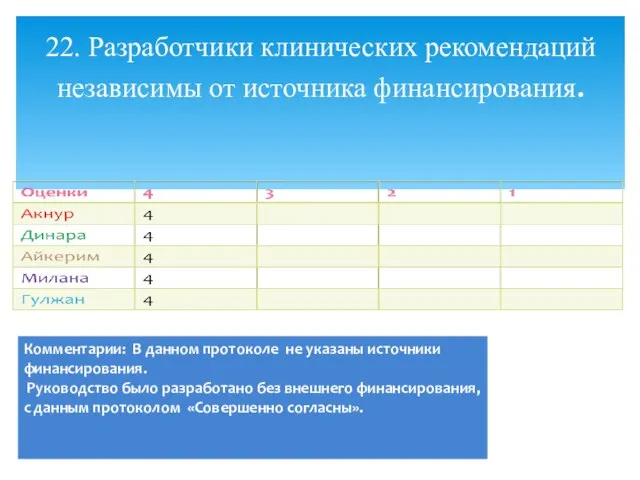
- 29. 22. Разработчики клинических рекомендаций независимы от источника финансирования.
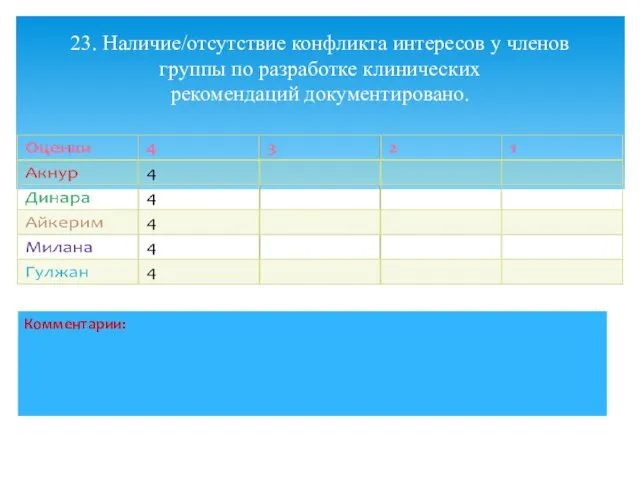
- 30. 23. Наличие/отсутствие конфликта интересов у членов группы по разработке клинических рекомендаций документировано.
- 32. Скачать презентацию











 Профилактика и лечение токсоплазмоза у ВИЧ-инфицированных
Профилактика и лечение токсоплазмоза у ВИЧ-инфицированных Загальна симптоматика нервових хвороб (Лекція №1)
Загальна симптоматика нервових хвороб (Лекція №1) Консультирование при параноидальных расстройствах
Консультирование при параноидальных расстройствах Заместительная почечная терапия
Заместительная почечная терапия Аденовирусная инфекция
Аденовирусная инфекция Основы трансфузиологии. История переливания кровезаменителей, крови и ее компонентов
Основы трансфузиологии. История переливания кровезаменителей, крови и ее компонентов Рахит у детей
Рахит у детей Организация амбулаторно-поликлинической помощи городскому населению
Организация амбулаторно-поликлинической помощи городскому населению Гигиена органов пищеварения
Гигиена органов пищеварения Метаболический синдром
Метаболический синдром Мониторинг газообмена: капнография
Мониторинг газообмена: капнография Медицинада қолданылатын электрофизикалық емдеу әдістері
Медицинада қолданылатын электрофизикалық емдеу әдістері Передний Инфаркт Миокарда
Передний Инфаркт Миокарда Физиология беременности и дискомфортные состояния
Физиология беременности и дискомфортные состояния Зәр шығару жүйесі
Зәр шығару жүйесі Здоровое питание
Здоровое питание Инфекции мочевыводящих путей. Хронический пиелонефрит у беременных
Инфекции мочевыводящих путей. Хронический пиелонефрит у беременных Контейнеры для съемных зубных протезов Y-Kelin Denture Box Denture Case
Контейнеры для съемных зубных протезов Y-Kelin Denture Box Denture Case Сестринский процесс при аллергодерматозах. Синдром Лайелла, отёк Квинке
Сестринский процесс при аллергодерматозах. Синдром Лайелла, отёк Квинке Интерпретация гравидограмм
Интерпретация гравидограмм Дифференциальная диагностика диффузных заболеваний печени
Дифференциальная диагностика диффузных заболеваний печени Жоба. Мал дәрігері мамандығы
Жоба. Мал дәрігері мамандығы Инфекциялық ауруларды алдын-алу және емдеу шаралары
Инфекциялық ауруларды алдын-алу және емдеу шаралары Семейная амавротическая идиотия
Семейная амавротическая идиотия Быть взрослым
Быть взрослым Противовоспалительные лекарственные средства
Противовоспалительные лекарственные средства Энзимопатиялар
Энзимопатиялар Металсыз протездеу жүйесі. Салыстырмалы сипаттама
Металсыз протездеу жүйесі. Салыстырмалы сипаттама