Содержание
- 2. Шерлок Холмс: «Фосфор! Странная смесь…Совершенно без запаха. Состав преступления теперь налицо…»
- 3. Фосфор
- 4. Строение атома фосфора
- 5. Открытие фосфора В поисках эликсира молодости и попытках получения золота алхимик XVII столетия Геннинг Бранд из
- 6. В России термин фосфор введен в 1746 году Михаилом Васильевичем Ломоносовым.
- 7. Фосфор занимает 13 место среди всех элементов.
- 8. Общая характеристика. неметалл, Ar=31 V группа, главная подгруппа 3 период, 3 ряд степени окисления -3.0,+1,+3,+5. оксиды
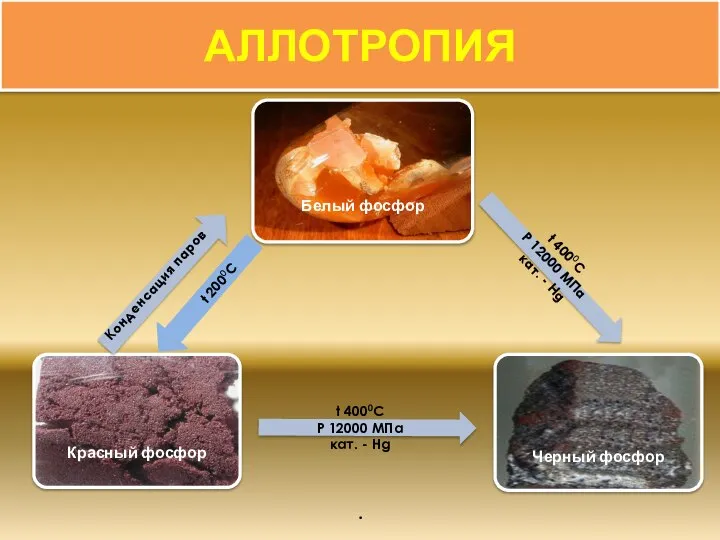
- 9. Способность атомов одного химического элемента образовывать несколько простых веществ называют аллотропией, а эти простые вещества –
- 10. АЛЛОТРОПИЯ t 2000C Конденсация паров .
- 11. Воскообразное, прозрачное вещество с характерным запахом, в присутствии примесей - следов красного Фосфора, мышьяка, железа и
- 12. Темно-малиновый порошок. Нерастворим в воде и сероуглероде. Химическая активность значительно ниже, чем у белого. На воздухе
- 13. Чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит. Не растворим в
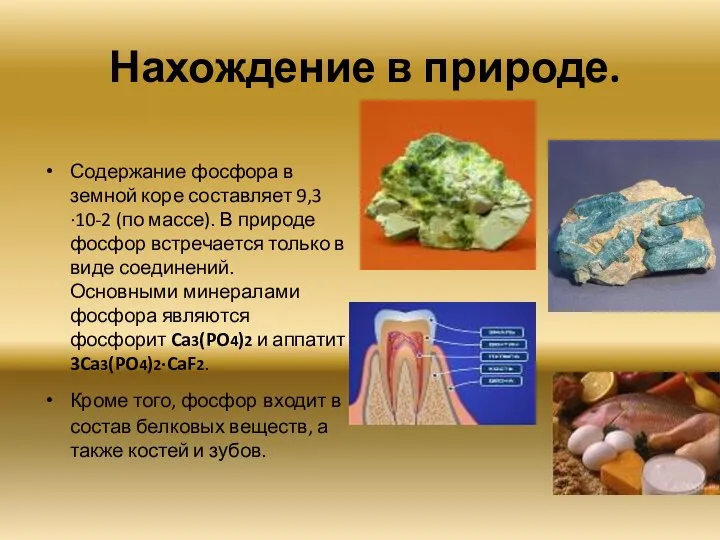
- 14. Нахождение в природе. Содержание фосфора в земной коре составляет 9,3·10-2 (по массе). В природе фосфор встречается
- 15. Химические свойства Реакция горения 4Р + 5О2 = 2Р2О5 2) Взаимодействие с активными металлами 3Mg +
- 17. Скачать презентацию












 Жири (тригліцериди)
Жири (тригліцериди) Каталитический крекинг. Промышленные установки
Каталитический крекинг. Промышленные установки Методическая разработка урока МНОГОАТОМНЫЕ СПИРТЫ
Методическая разработка урока МНОГОАТОМНЫЕ СПИРТЫ Хлороводород и соляная кислота
Хлороводород и соляная кислота Тема урока: Химические свойства алкенов. Получение.
Тема урока: Химические свойства алкенов. Получение. Пищевая микробиология. Превращения азотсодержащих веществ
Пищевая микробиология. Превращения азотсодержащих веществ Химическая термодинамика биологических процессов
Химическая термодинамика биологических процессов Биохимия эритроцита
Биохимия эритроцита Органічна хімія
Органічна хімія Индикаторы в нашей жизни
Индикаторы в нашей жизни Термическая обработка. Превращения при непрерывном охлаждении аустенита. Превращения при отпуск
Термическая обработка. Превращения при непрерывном охлаждении аустенита. Превращения при отпуск Гидролиз солей.
Гидролиз солей.  Розчини
Розчини Методы разделения и концентрирования. Жидкостная экстракция органических соединений. (Лекция 2)
Методы разделения и концентрирования. Жидкостная экстракция органических соединений. (Лекция 2) Антисептики и дезинфектанты
Антисептики и дезинфектанты Ферменты
Ферменты Важнейшие классы неорганических соединений Школа № 279 г. Санкт-Петербург Е. В Переверзева
Важнейшие классы неорганических соединений Школа № 279 г. Санкт-Петербург Е. В Переверзева  Харчові добавки
Харчові добавки  Типы химических реакций
Типы химических реакций Исследование шоколада на содержание посторонних примесей. Выполнила: Астраханцева Виктория ученица 11 «Б» класса Лицея №95 Научн
Исследование шоколада на содержание посторонних примесей. Выполнила: Астраханцева Виктория ученица 11 «Б» класса Лицея №95 Научн Алканы: гомологический ряд, изомерия и номенклатура алканов. МБОУ СОШ №99 г.о. Самара Предмет: Химия Класс: 10 Учебник: О.С. Габр
Алканы: гомологический ряд, изомерия и номенклатура алканов. МБОУ СОШ №99 г.о. Самара Предмет: Химия Класс: 10 Учебник: О.С. Габр Пример практического тура. Всероссийская олимпиада школьников по химии
Пример практического тура. Всероссийская олимпиада школьников по химии Колообіг речовин у природі
Колообіг речовин у природі  Хлориды. Получение
Хлориды. Получение Презентация Мыло. Синтетические моющие средства
Презентация Мыло. Синтетические моющие средства Презентация к уроку окружающего мира по теме: ,,Про воздух и про воду” Цель урока: знакомство учеников с богатствами природы - воздухом и водой, их свойствами. Задачи: Продолжить расширение и углубление представлений
Презентация к уроку окружающего мира по теме: ,,Про воздух и про воду” Цель урока: знакомство учеников с богатствами природы - воздухом и водой, их свойствами. Задачи: Продолжить расширение и углубление представлений  Разложение отходов. 11 класс
Разложение отходов. 11 класс Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії
Загальна характеристика неметалічних елементів. Неметали як прості речовини. Явище алотропії