Содержание
- 2. ОЖИРЕНИЕ определение самостоятельное заболевание синдром, обусловленный наличием другой соматической либо эндокринной патологии - хроническое, мультифакторное, гетерогенное,
- 3. Эпидемиология ожирения В настоящее время в мире cвыше 250 млн. больных ожирением: (более 7% всего населения
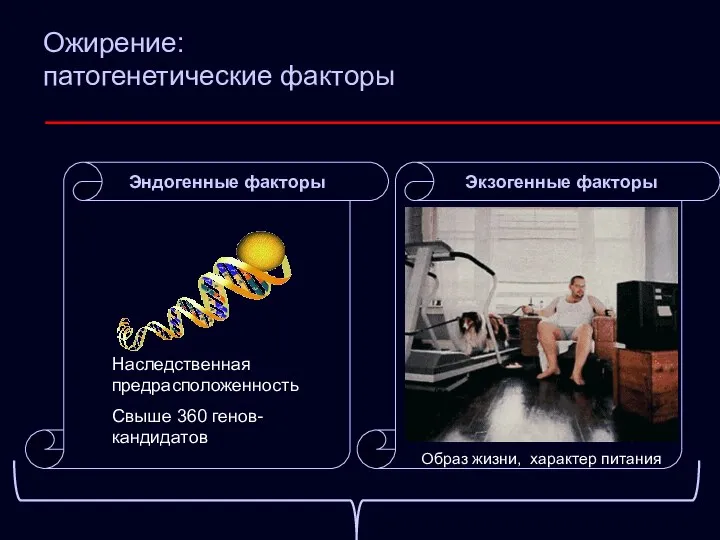
- 4. Ожирение: патогенетические факторы Наследственная предрасположенность Свыше 360 генов-кандидатов Экзогенные факторы Образ жизни, характер питания Эндогенные факторы
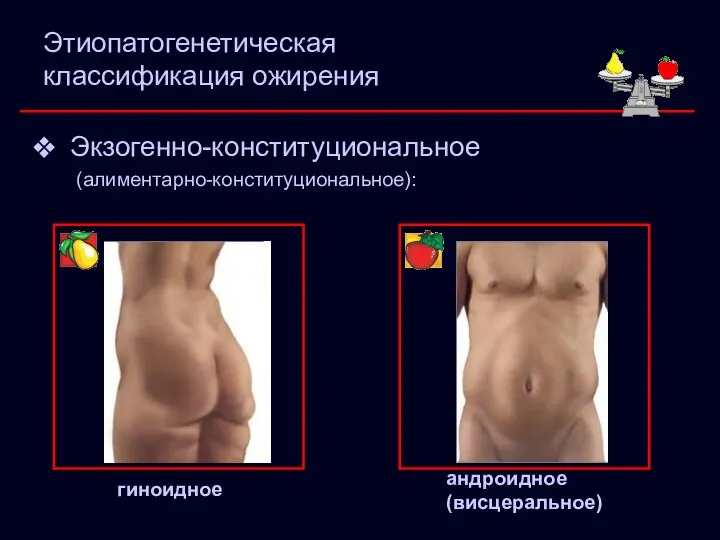
- 5. Этиопатогенетическая классификация ожирения Экзогенно-конституциональное (алиментарно-конституциональное): гиноидное андроидное (висцеральное)
- 6. В генезе нарушения чувствительности тканей к инсулину задействованы многие механизмы: липотоксичность, глюкотоксичность, стресс эндоплазматического ретикулума (нарушение
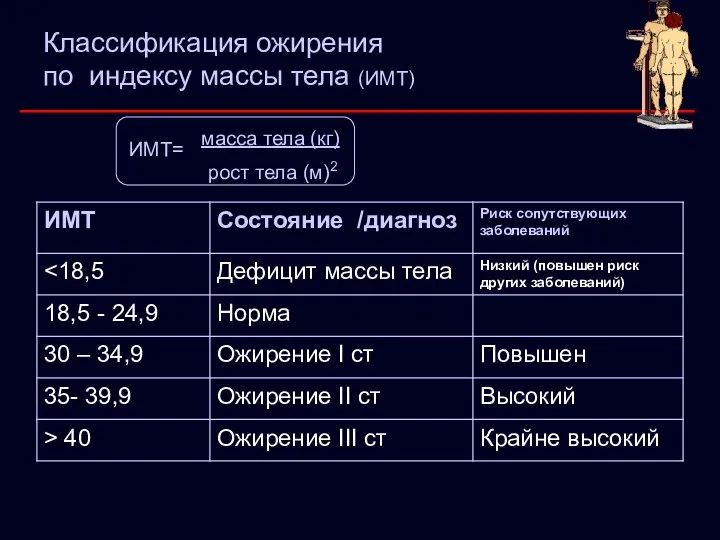
- 7. Классификация ожирения по индексу массы тела (ИМТ) масса тела (кг) рост тела (м)2 ИМТ=
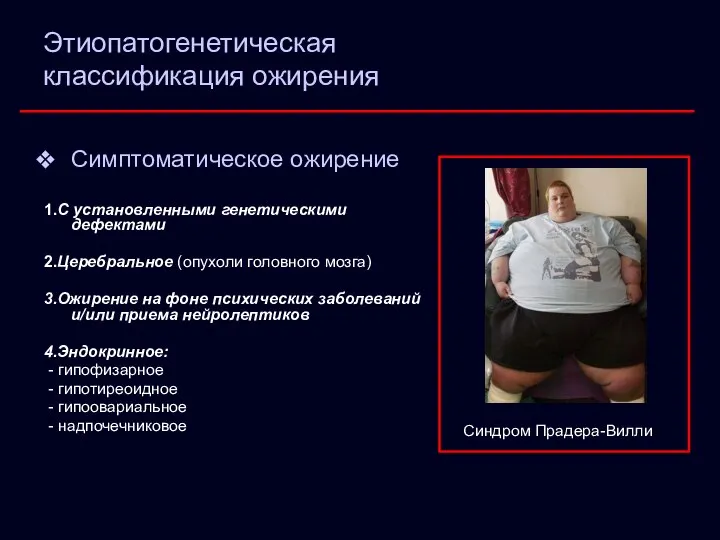
- 8. Этиопатогенетическая классификация ожирения Симптоматическое ожирение 1.С установленными генетическими дефектами 2.Церебральное (опухоли головного мозга) 3.Ожирение на фоне
- 9. Моногенные заболевания являются причиной ожирения в единичных случаях Чаще ожирение развивается при наличии кластера генов, каждый
- 10. Генетическая предрасположенность при ожирении: Ген ADIPOQ локализован на длинном плече хромосомы 3 (3q27) и кодирует белок
- 11. Ген PPARG состоит из 9 экзонов и 8 интронов, локализован на коротком плече хромосомы 3 (3р25)
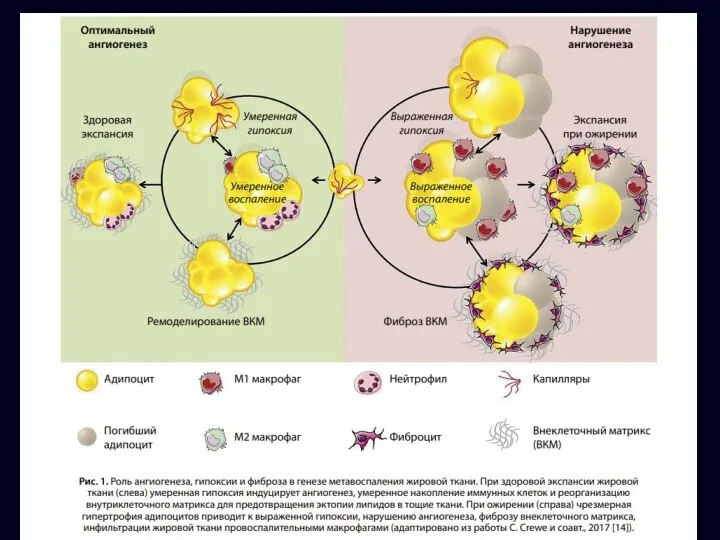
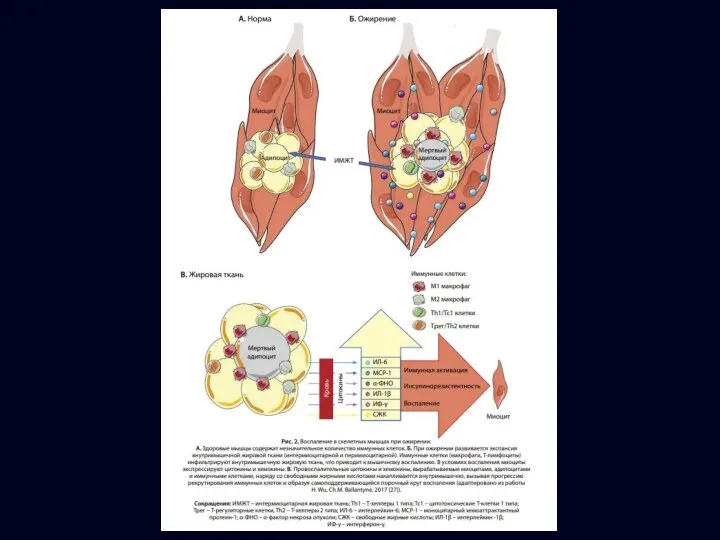
- 12. При ожирении жировая ткань подвергается патологическому ремоделированию. Нарушение адипогенеза приводит к формированию гипертрофического ожирения. Гипертрофированные адипоциты
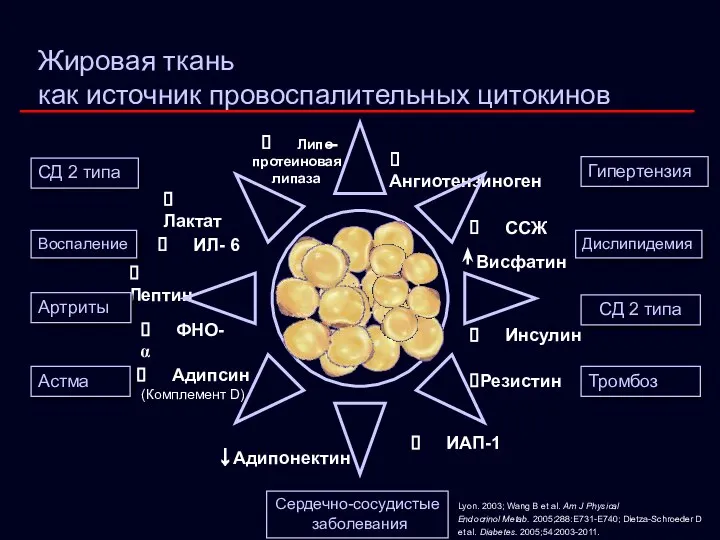
- 15. Жировая ткань как источник провоспалительных цитокинов ? Лактат ? Ангиотензиноген ? Лептин ? Адипсин (Комплемент D)
- 16. Механизмы регуляции аппетита
- 17. α -меланоцитостимулирующий гормон лептин кортиколиберин кокаин-амфетамин регулируемый транскрипт глюкагоноподобный пептид грелин меланокортин орексин (гипокретин) А и
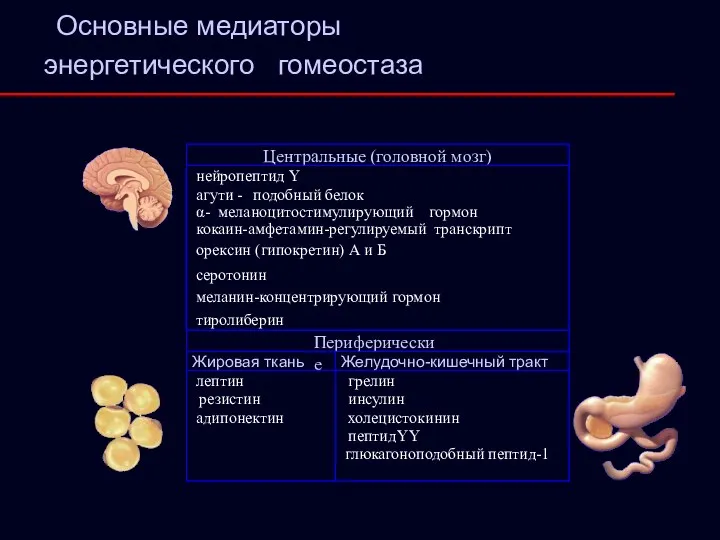
- 18. Центральные (головной мозг) нейропептид Y агути - подобный белок тиролиберин меланин-концентрирующий гормон орексин ( гипокретин) А
- 19. Лептин («Leptos» – тонкий) Ген, контролирующий синтез гормона – Ob-ген Энергетический обмен: Обеспечение энергетического гомеостаза («голос»
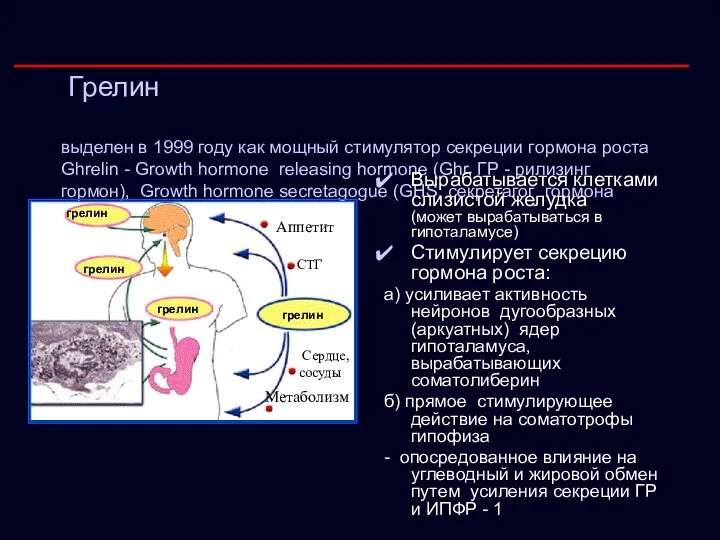
- 20. Грелин выделен в 1999 году как мощный стимулятор секреции гормона роста Ghrelin - Growth hormone releasing
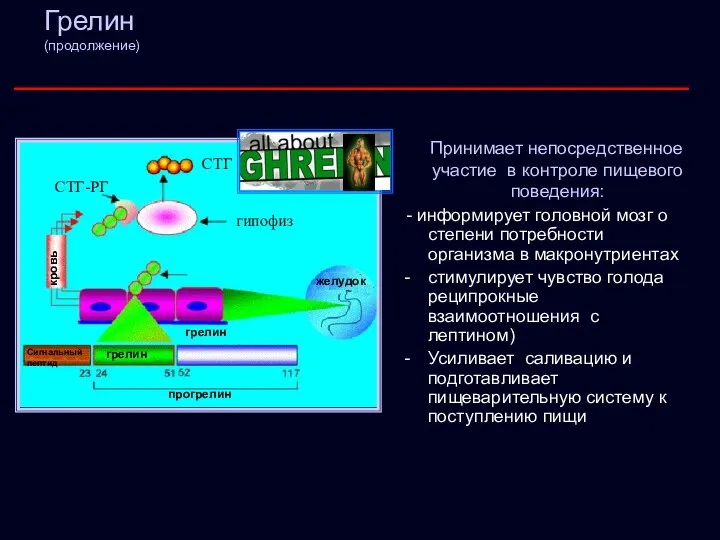
- 21. Грелин (продолжение) Принимает непосредственное участие в контроле пищевого поведения: - информирует головной мозг о степени потребности
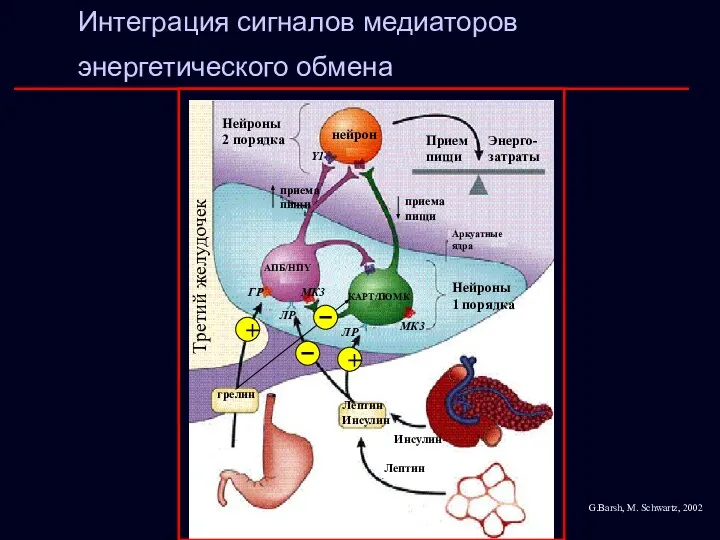
- 22. Y1 МК4 Интеграция сигналов медиаторов энергетического обмена МК4 Y1 нейрон Нейроны 2 порядка Прием пищи Энерго-затраты
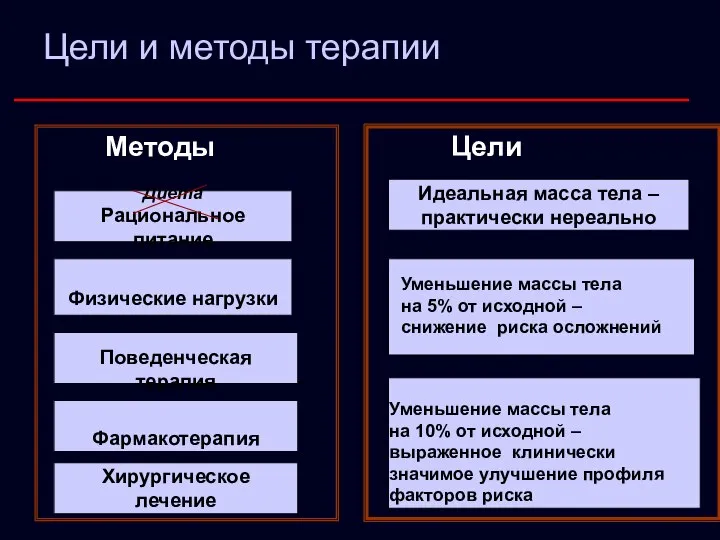
- 23. Цели и методы терапии Методы Цели Фармакотерапия Диета Рациональное питание Поведенческая терапия Физические нагрузки Хирургическое лечение
- 24. Показания к фармакотерапии При ИМТ > 30 Снижение массы тела менее чем на 5% от исходной
- 25. Желудочно-кишечные липазы – ключевые ферменты, расщепляющие жиры пищи на моноглицериды, свободные жирные кислоты и глицерин, которые
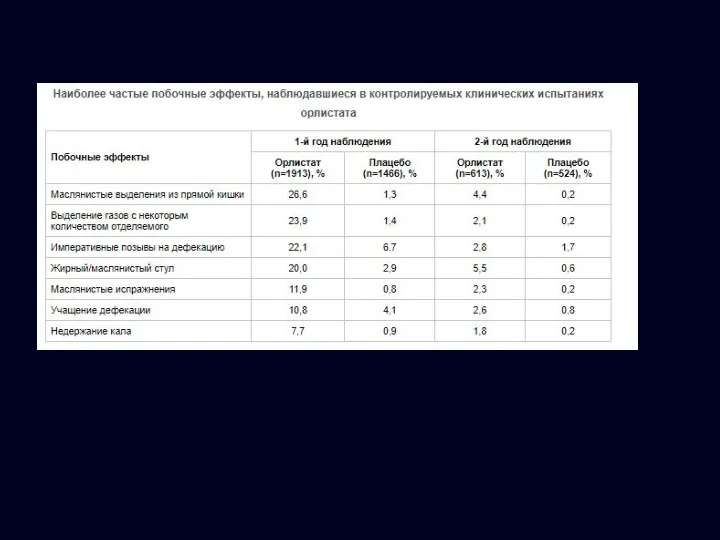
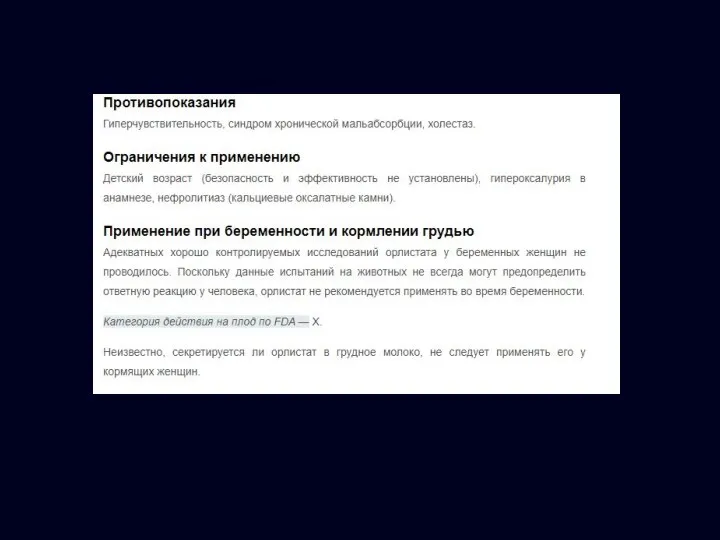
- 26. Побочные эффекты: Ксеникал: схема назначения и побочные эффекты 120 мг с каждым основным приемом пищи Если
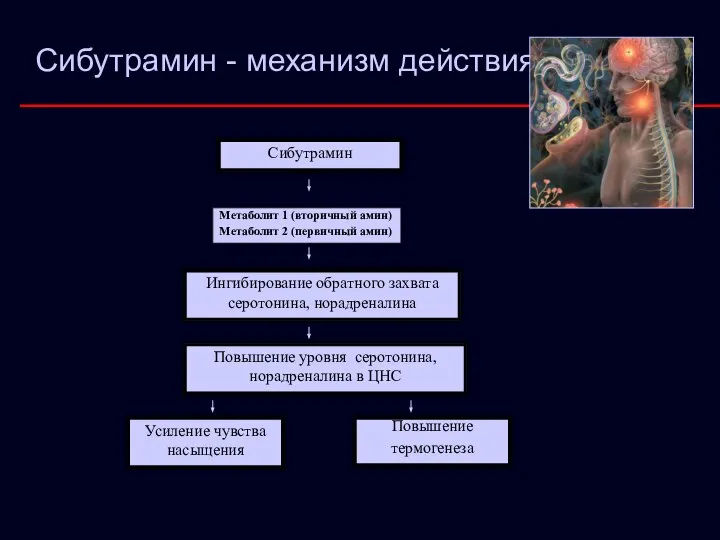
- 30. Сибутрамин Метаболит 1 (вторичный амин) Метаболит 2 (первичный амин) Ингибирование обратного захвата серотонина, норадреналина Повышение уровня
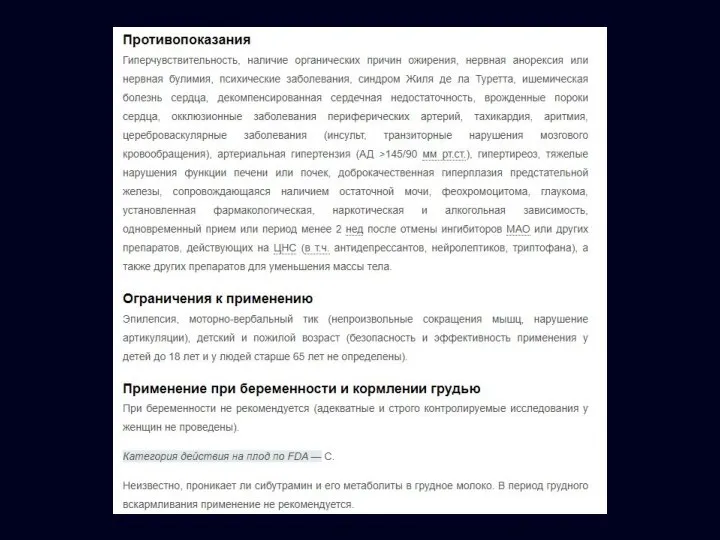
- 31. По 1 т (10 мг) 1 раз в день При отсутствии эффекта через 4 недели доза
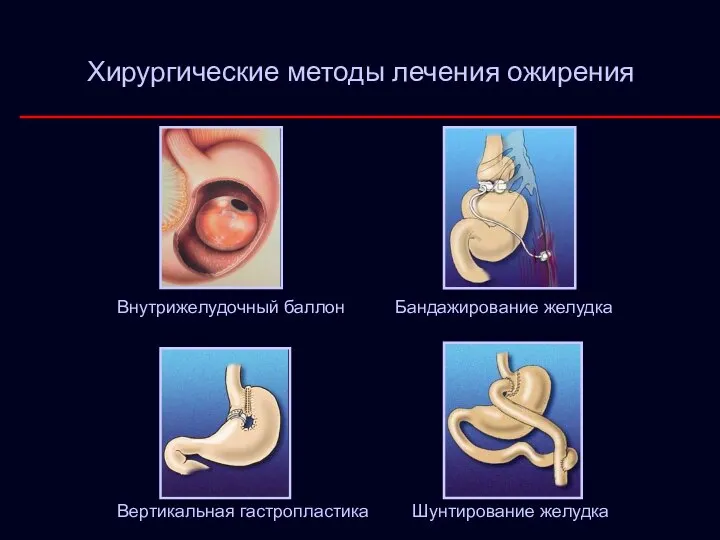
- 34. Хирургические методы лечения ожирения Внутрижелудочный баллон Бандажирование желудка Вертикальная гастропластика Шунтирование желудка
- 36. Скачать презентацию
















 Вирусы
Вирусы Потребность пациента в поддержании нормальной температуры тела
Потребность пациента в поддержании нормальной температуры тела Острая артериальная ишемия
Острая артериальная ишемия Синтетические противомикробные средства
Синтетические противомикробные средства Внезапные состояния при заболеваниях желудочно-кишечного тракта, эндокринной системы и органов мочевыделения. (Лекция 6)
Внезапные состояния при заболеваниях желудочно-кишечного тракта, эндокринной системы и органов мочевыделения. (Лекция 6) Тромболизис. Тромболитическая терапия
Тромболизис. Тромболитическая терапия Еркек жыныс мүшесін қалыңдату әдістері
Еркек жыныс мүшесін қалыңдату әдістері Черепно-мозговая травма. Первая медицинская и доврачебная помощь
Черепно-мозговая травма. Первая медицинская и доврачебная помощь Опухолевые стволовые клетки на примере рака молочной железы
Опухолевые стволовые клетки на примере рака молочной железы Болевые синдромы поясничной области и их коррекция
Болевые синдромы поясничной области и их коррекция Анемия. Виды анемий
Анемия. Виды анемий Тулеремия және оба қоздырғыштары
Тулеремия және оба қоздырғыштары Дыхательная недостаточность
Дыхательная недостаточность Phylogenetic disorders of skull
Phylogenetic disorders of skull Кровотечения в последовом и в раннем послеродовом периоде
Кровотечения в последовом и в раннем послеродовом периоде Заболевания придатков глаза, роговицы и склеры. Лекция №2
Заболевания придатков глаза, роговицы и склеры. Лекция №2 Өлімнің коммуникативтік этикалық мәселелері
Өлімнің коммуникативтік этикалық мәселелері Кожа – индикатор здоровья
Кожа – индикатор здоровья Актуальные вопросы радиационной гигиены в отечественной медицине
Актуальные вопросы радиационной гигиены в отечественной медицине Показатели детской инвалидности муз дгб№4
Показатели детской инвалидности муз дгб№4 Рекомендации по созданию презентации на научно-практические конференции по медицине
Рекомендации по созданию презентации на научно-практические конференции по медицине Рганизация всех видов медицинских осмотров. Медсанчасти, медпункты, здравпункты предприятий. Производственная аптечка
Рганизация всех видов медицинских осмотров. Медсанчасти, медпункты, здравпункты предприятий. Производственная аптечка Сестринская деятельность в реабилитации пациентов с патологией ЦНС
Сестринская деятельность в реабилитации пациентов с патологией ЦНС Подагра
Подагра Клиническое обследование. Clinical examination. Лекция 2
Клиническое обследование. Clinical examination. Лекция 2 Меры предотвращения распространения гриппа, острых респираторных вирусных инфекций и новой коронавирусной инфекции
Меры предотвращения распространения гриппа, острых респираторных вирусных инфекций и новой коронавирусной инфекции Бактерийные и вирусные лечебные, профилактические и диагностические препараты
Бактерийные и вирусные лечебные, профилактические и диагностические препараты Офтальмоскопические признаки диабетической ретинопатии
Офтальмоскопические признаки диабетической ретинопатии