Содержание
- 2. Список литературы Овечкин A.M. Профилактика послеоперационного болевого синдрома. Патогенетические основы и клиническое применение: Автореф. дис... д-ра
- 3. Эпидемиология послеоперационной боли Проблема лечения послеоперационной боли остается актуальной как в нашей стране, так и за
- 4. Эпидемиология послеоперационной боли На IV Конгрессе европейских ассоциаций по изучению боли (Прага, сентябрь 2003 г.) было
- 5. Эпидемиология послеоперационной боли В России подобные масштабные исследования пока не проводились, поэтому можно руководствоваться только отдельными
- 6. Современные возможности лечения послеоперационной боли В уже упоминавшемся исследовании, выполненном нами в конце 1990-х годов, было
- 8. Опиоидная анальгезия и способы ее оптимизации Традиционно системное введение опиоидных анальгетиков рассматривалось в качестве основы послеоперационного
- 10. Полученные данные свидетельствуют о том, что стандартом мониторинга при опиоидной анальгезии должна быть пульсоксиметрия, лучше в
- 11. В заключение данного параграфа приведем некоторые постулаты доказательной медицины, касающиеся послеоперационного назначения опиоидных анальгетиков (Acute Pain
- 12. Нестероидные противовоспалительные препараты Важнейшая роль тканевого воспаления в механизмах центральной сенситизации, а следовательно, и в фор-
- 13. Нестероидные противовоспалительные препараты Важнейшая роль тканевого воспаления в механизмах центральной сенситизации, а следовательно, и в фор-
- 14. Тромбоциты продуцируют только ЦОГ-1, cледовательно, селективные ингибиторы ЦОГ-2 не оказывают влияния на их функцию. Данный факт
- 15. Парацетамол Из всех неопиоидных анальгетиков парацетамол является наиболее безопасным и характеризуется наилучшим соотношением «цена — качество».
- 16. Парацетамол Приведем некоторые данные доказательной медицины, касающиеся эффективности и целесообразности при- менения НПВП и парацетамола (Acute
- 17. Антагонисты NMDA-рецепторов Кетамин является уникальным внутривенным анестетиком, обладающим свойствами анальгетика. Известные побочные эффекты кетамина привели к
- 18. Целесообразность использования кетамина в схеме послеоперационного обезболивания подтверждена данными доказательной медицины (Acute Pain Management: Scientific Evidence,
- 19. Прочие неопиоидные анальгетики Болюсное внутривенное введение 50 мг/кг магнезии в процессе индукции анестезии повышает качество обе-
- 20. Инфильтрация и орошение краев раны растворами ма Инфильтрация краев раны МА длительного действия удлиняет время первого
- 21. Местные анестетики, используемые для послеоперационной регионарной анальгезии Использование МА для послеоперационного обезболивания предусматривает их введение в
- 22. В целом ропивакаин является примерно на 40 % менее кардиотоксичным и примерно на 30 % менее
- 26. Скачать презентацию
Список литературы
Овечкин A.M. Профилактика послеоперационного болевого синдрома. Патогенетические основы и клиническое
Список литературы
Овечкин A.M. Профилактика послеоперационного болевого синдрома. Патогенетические основы и клиническое
Овечкин A.M., Морозов Д.В., Жарков И.П. Обезболивание и седация в послеоперационном периоде: реалии и возможности // Вестник интенсивной терапии. — № 4. — 2001. — С. 47-60.
Осипова Н.А. Антиноцицептивные компоненты общей анестезии и послеоперационной аналгезии // Анест. и реаниматол. — 1998. — № 5. — С. 11-15.
Осипова Н.А., Петрова В.В., Береснев В.А. и др. Профилактическая анальгезия — новое направление в анестезиологии. Рождение и развитие идеи в работах МНИОИ им. П.А. Герцена // Анест. и реаниматол. — 1999. — № 6. — С. 13-18.
http://urgent.mif-ua.com/archive/issue-22650/article-22662/
Эпидемиология послеоперационной боли
Проблема лечения послеоперационной боли остается актуальной как в нашей
Эпидемиология послеоперационной боли
Проблема лечения послеоперационной боли остается актуальной как в нашей
*(Овечкин А.М., 2000; Harmer M., Davies К., 1998; Neugebauer E., 1998; Carr D., Goudas L., 1999; Chauvin M., 1999; Dolin S., 2002; Seers К., 2004).
Эпидемиология послеоперационной боли
На IV Конгрессе европейских ассоциаций по изучению боли (Прага,
Эпидемиология послеоперационной боли
На IV Конгрессе европейских ассоциаций по изучению боли (Прага,
Эпидемиология послеоперационной боли
В России подобные масштабные исследования пока не проводились, поэтому
Эпидемиология послеоперационной боли
В России подобные масштабные исследования пока не проводились, поэтому
Современные возможности лечения послеоперационной боли
В уже упоминавшемся исследовании, выполненном нами в
Современные возможности лечения послеоперационной боли
В уже упоминавшемся исследовании, выполненном нами в
В большинстве развитых стран послеоперационное обезболивание осуществляется в соответствии с приня- тыми национальными и международными стандартами. По ряду причин они не могут быть полностью приняты на вооружение в Российской Федерации (приказы, ограничивающие назначения опиоидных анальгетиков, отсутствие разрешений на способы применения некоторых препаратов, отсутствие возможности широкого применения ме- тодов контролируемой пациентом анальгезии и т.д.). Тем не менее в определенной степени можно руководство- ваться международными рекомендациями, в частности Acute Pain Management: Scientific Evidence (2005), сумми- ровавшими данные доказательной медицины об эффективности различных средств и методов послеоперационной анальгезии, а также руководством Postoperative Pain Management — Good Clinical Practice (2005), переведенным на русский язык.
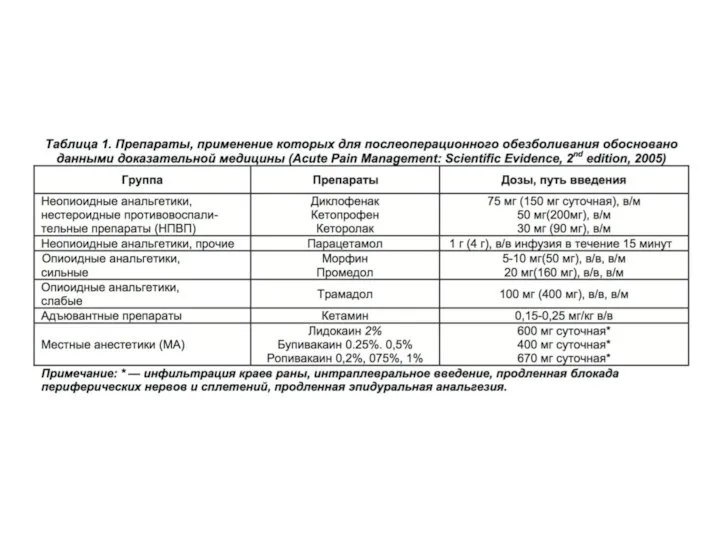
В настоящее время во многих клиниках внедрена формулярная система использования лечебных препаратов тех или иных групп, целесообразность применения которых подтверждена данными доказательной медицины, а также обусловлена потребностями и особенностями конкретного лечебного учреждения. Мы полагаем, что все хирургические подразделения, а также отделения анестезиологии, реанимации и интенсивной терапии должны иметь в своем арсенале только те анальгетики и анестетики, эффективность и безопасность назначения которых подтверждена доказательствами I (систематизированные обзоры и метаанализы) и II (рандомизированные контро- лируемые исследования с определенными результатами) уровня (табл. 1).
Опиоидная анальгезия и способы ее оптимизации
Традиционно системное введение опиоидных анальгетиков рассматривалось
Опиоидная анальгезия и способы ее оптимизации
Традиционно системное введение опиоидных анальгетиков рассматривалось
Наиболее эффективные попытки улучшения качества послеоперационной опиоидной анальгезии основаны на оптимизации способов введения препаратов. Самым современным методом является контролируемая пациентом анальгезия (КПА), в наибольшей степени ориентированная на индивидуальные потребности пациента в обезболивании. При необходимости, нажав на кнопку дистанционного устройства, пациент сам себе вводит дополнительный болюс анальгетика, что придает ему ощущение независимости и уверенности, а также облегчает работу среднего медперсонала.
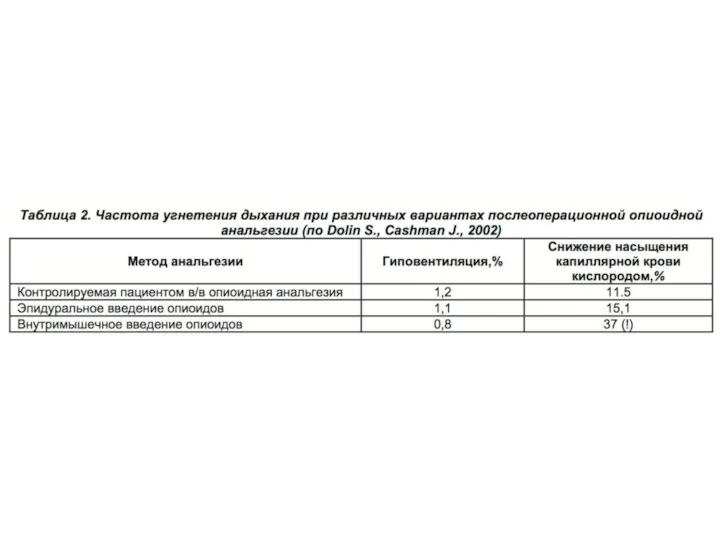
Надо сказать, что высокотехнологичные методы послеоперационного обезболивания, такие как КПА и ЭА, проводимая посредством непрерывной эпидуральной инфузии, в развитых странах в совокупности применяются у 35–50 % пациентов, перенесших хирургические вмешательства. Данные методы характеризуются высокой эффективностью и сравнительной безопасностью. В уже упоминавшемся крупном британском исследовании (Dolin S., Cashman J., 2002) была проанализирована частота депрессии дыхания при использовании опиоидов по- средством внутривенной КПА, а также при их внутримышечном и эпидуральном введении (табл. 2).
Полученные данные свидетельствуют о том, что стандартом мониторинга при опиоидной анальгезии
Полученные данные свидетельствуют о том, что стандартом мониторинга при опиоидной анальгезии
Широкое развитие контролируемой пациентом опиоидной анальгезии в нашей стране ограничено: а) дефицитом инфузионных помп, имеющих модуль для КПА; б) проблемами учета и списывания опиоидных анальгетиков. Например, для проведения КПА промедолом шприц инфузионной помпы (50–60 мл) должен быть заполнен 100 мг препарата. При списывании 5 ампул промедола на одного больного в сутки могут возникнуть вопросы как у администрации клиники, так и у представителей структур, контролирующих расход наркотических анальгетиков в медицинских учреждениях.
В заключение данного параграфа приведем некоторые постулаты доказательной медицины, касающиеся послеоперационного
В заключение данного параграфа приведем некоторые постулаты доказательной медицины, касающиеся послеоперационного
1. Частота клинически значимых побочных эффектов опиоидов имеет дозозависимый характер (доказатель- ства II уровня).
2. У взрослых пациентов возраст в большей степени, чем масса тела, определяет требуемую дозу опиоидов (доказательства IV уровня).
3. Нарастание уровня седации является более ранним признаком угнетения дыхания опиоидами, чем сниже- ние частоты дыхания.
Нестероидные противовоспалительные препараты
Важнейшая роль тканевого воспаления в механизмах центральной сенситизации, а
Важнейшая роль тканевого воспаления в механизмах центральной сенситизации, а
Из препаратов, имеющих форму для парентерального введения и подавляющих активность циклооксигеназы как 1-го, так и 2-го типа, наибольшее применение находят диклофенак, кеторолак и кетопрофен (табл. 4), включен- ные во все европейские рекомендации и протоколы послеоперационного обезболивания.
С точки зрения патофизиологии острой боли оптимальным считается введение 1-й дозы НПВП за 30–40 минут до кожного разреза (принцип предупреждающей анальгезии). Такая методика позволяет существенно снизить ин- тенсивность боли и потребность в послеоперационном назначении опиоидных анальгетиков (Осипова Н.А. и др., 1999; Овечкин А.М., 2000).
Не так давно были получены данные о положительном влиянии НПВП на выживаемость пациентов, перенесших обширные хирургические вмешательства, в том числе и осложненные абдоминальной хирургической инфекцией. Простагландин Е2 способствует белковому распаду, причем этот эффект усиливается на фоне лихорадки и сепси- са. НПВП способны уменьшить потерю мышечной массы за счет подавления синтеза PGE2 и снижения деградации протеина. Оценивая потери азота в послеоперационном периоде у пациентов, которым проводилась длительная ЭА, установили, что комбинирование ЭА с НПВП позволяет снизить потери азота на 75–80 % в первые трое суток после операции по сравнению с контрольной группой, получавшей только ЭА (Asoh Т., 1987).
Нестероидные противовоспалительные препараты
Важнейшая роль тканевого воспаления в механизмах центральной сенситизации, а
Важнейшая роль тканевого воспаления в механизмах центральной сенситизации, а
Из препаратов, имеющих форму для парентерального введения и подавляющих активность циклооксигеназы как 1-го, так и 2-го типа, наибольшее применение находят диклофенак, кеторолак и кетопрофен (табл. 4), включен- ные во все европейские рекомендации и протоколы послеоперационного обезболивания.
С точки зрения патофизиологии острой боли оптимальным считается введение 1-й дозы НПВП за 30–40 минут до кожного разреза (принцип предупреждающей анальгезии). Такая методика позволяет существенно снизить ин- тенсивность боли и потребность в послеоперационном назначении опиоидных анальгетиков (Осипова Н.А. и др., 1999; Овечкин А.М., 2000).
Не так давно были получены данные о положительном влиянии НПВП на выживаемость пациентов, перенесших обширные хирургические вмешательства, в том числе и осложненные абдоминальной хирургической инфекцией. Простагландин Е2 способствует белковому распаду, причем этот эффект усиливается на фоне лихорадки и сепси- са. НПВП способны уменьшить потерю мышечной массы за счет подавления синтеза PGE2 и снижения деградации протеина. Оценивая потери азота в послеоперационном периоде у пациентов, которым проводилась длительная ЭА, установили, что комбинирование ЭА с НПВП позволяет снизить потери азота на 75–80 % в первые трое суток после операции по сравнению с контрольной группой, получавшей только ЭА (Asoh Т., 1987).
Тромбоциты продуцируют только ЦОГ-1, cледовательно, селективные ингибиторы ЦОГ-2 не оказывают влияния
Тромбоциты продуцируют только ЦОГ-1, cледовательно, селективные ингибиторы ЦОГ-2 не оказывают влияния
В последние годы неоднократно поднимался вопрос о крайне нежелательном тромбогенном потенциале селек- тивных ингибиторов ЦОГ-2. Препараты этого типа угнетают продукцию эндотелиального простациклина, сохраняя при этом синтез тромбоксана тромбоцитами, а также их способность к агрегации. В ряде исследований был выяв- лен повышенный риск развития инфаркта миокарда у пациентов, получавших селективные НПВП.
В настоящее время селективные ингибиторы ЦОГ-2 являются предметом пристальных международных иссле- дований, направленных на изучение безопасности их применения у пациентов с патологией сердечно-сосудистой системы (перенесших острый инфаркт миокарда, страдающих стенокардией, гипертонией и т.д.). Рофекоксиб был отозван компанией-производителем с рынка, использование вальдекоксиба временно приостановлено до получения дополнительных данных о частоте кардиоваскулярных осложнений, а также побочных воздействий препарата на кожу и слизистые оболочки. Парекоксиб, инъекционный селективный ингибитор ЦОГ-2, в настоящее время доступен в клинике и рекомендован для кратковременного применения с целью послеоперационного обезболивания. Все НПВП у пациентов с патологией сердечно-сосудистой системы должны использоваться с осторожностью.
Нестероидные противовоспалительные препараты
Парацетамол
Из всех неопиоидных анальгетиков парацетамол является наиболее безопасным и характеризуется наилучшим
Парацетамол
Из всех неопиоидных анальгетиков парацетамол является наиболее безопасным и характеризуется наилучшим
Механизм действия парацетамола отличается от НПВП. По сравнению с опиоидами и НПВП соответственно, парацетамол не имеет эндогенных рецепторов и практически не подавляет активность циклооксигеназы на пери- ферии. Появляется все больше доказательств центрального антиноцицептивного эффекта парацетамола. Веро- ятные механизмы его включают: а) подавление активности ЦОГ-2 в ЦНС (профилактика развития вторичной гипе- ральгезии); б) подавление активности ЦОГ-3 (существование которой предполагается и которая, видимо, обладает селективной чувствительностью к парацетамолу); в) усиление активности нисходящих тормозных серотонинерги- ческих путей. Парацетамол препятствует продукции простагландина на уровне клеточной транскрипции, т.е. не- зависимо от уровня активности ЦОГ; является эффективным анальгетиком, потенциал которого лишь несколько уступает стандартным дозам морфина или НПВП.
Появление внутривенной формы парацетамола существенно повысило ценность и расширило показания к при- менению препарата в качестве базисного компонента мультимодальной послеоперационной анальгезии. Внутри- венный парацетамол превосходит таблетированные формы по безопасности, поскольку характеризуется более предсказуемой плазменной концентрацией в раннем послеоперационном периоде. При пероральном назначении выявлены значительные колебания концентрации парацетамола в плазме в раннем послеоперационном периоде, в том числе достижение опасно высоких уровней, по сравнению с внутривенным применением (Petterson P., 2004).
В настоящее время в Европе парацетамол в послеоперационном периоде получают 90–95 % пациентов. Обычно пре- парат вводят внутривенно во время операции, примерно за 30 минут до ее окончания, что обеспечивает спокойное, без- болезненное пробуждение. Как мы уже упоминали, отсутствие боли в течение первых 4–5 часов после операции положи- тельно влияет на последующую динамику болевого синдрома. Повторно 1 г парацетамола вводят через 4 часа, а затем каждые 6 часов (максимальная доза — 4 г в сутки). Через 1–3 дня применения внутривенного парацетамола пациентов переводят на его пероральную форму, которая является основным анальгетиком, назначаемым при выписке из клиники.
В связи с вероятностью возникновения побочных эффектов при назначении как традиционных НПВП, так и се- лективных ингибиторов ЦОГ-2 пациентам с патологией сердечно-сосудистой системы можно полагать, что пара- цетамол в ближайшее время будет играть все большую роль в послеоперационном обезболивании (Hillis W., 2002).
Парацетамол
Приведем некоторые данные доказательной медицины, касающиеся эффективности и целесообразности при- менения
Парацетамол
Приведем некоторые данные доказательной медицины, касающиеся эффективности и целесообразности при- менения
1. Парацетамол является эффективным препаратом для лечения острой боли (доказательства I уровня, Кокра- новская база данных).
2. Сочетание НПВП с парацетамолом повышает эффективность обезболивания (доказательства I уровня).
3. НПВП и селективные ингибиторы ЦОГ-2 являются эквипотенциальными эффективными анальгетиками для лечения острой боли (доказательства I уровня, Кокрановская база данных).
4. Ингибиторы ЦОГ-2 и НПВП оказывают равное побочное действие на функцию почек (доказательства I уровня).
5. Парацетамол, НПВП и ингибиторы ЦОГ-2 являются важнейшими компонентами мультимодальной анальге-зии (доказательства II уровня).
6. Риск негативного влияния НПВП и ингибиторов ЦОГ-2 повышается у пациентов с исходной почечной недостаточностью различной степени, гиповолемией, гипотензией, параллельным назначением прочих нефро- токсичных препаратов.
Антагонисты NMDA-рецепторов
Кетамин является уникальным внутривенным анестетиком, обладающим свойствами анальгетика. Известные побочные
Антагонисты NMDA-рецепторов
Кетамин является уникальным внутривенным анестетиком, обладающим свойствами анальгетика. Известные побочные
Интересно отметить, что средние дозы кетамина (250 мкг/кг) в послеоперационном периоде способны повы- сить качество обезболивания у пациентов, резистентных к опиоидным анальгетикам. Как известно, при исполь- зовании значительных доз опиоидов короткого действия (фентанил, суфентанил) может остро развиться стойкая опиоидиндуцированная гиперальгезия. Для профилактики данного состояния используют повторные введения ма- лых доз кетамина (Laulin J., 2002).
Целесообразность использования кетамина в схеме послеоперационного обезболивания подтверждена данными доказательной медицины
Целесообразность использования кетамина в схеме послеоперационного обезболивания подтверждена данными доказательной медицины
1. Кетамин оказывает опиоидсберегающий эффект при назначении в послеоперационном периоде, но не снижает частоту индуцированных опиоидами побочных эффектов (доказательства I уровня).
2. Кетамин, как антагонист NMDA-рецепторов, может оказывать эффект предупреждающей анальгезии (доказательства I уровня).
3. Кетамин повышает качество обезболивания у пациентов с интенсивной послеоперационной болью, резистентной к назначению опиоидов (доказательства II уровня).
Антагонисты NMDA-рецепторов
Прочие неопиоидные анальгетики
Болюсное внутривенное введение 50 мг/кг магнезии в процессе индукции
Прочие неопиоидные анальгетики
Болюсное внутривенное введение 50 мг/кг магнезии в процессе индукции
Габапентин (структурный аналог гамма-аминомасляной кислоты) является антиконвульсантом, достаточно широко используемым для лечения хронической нейропатической боли. Может использоваться в качестве адъю- вантного препарата и в комплексной терапии острой послеоперационной боли. В частности, пероральное назна- чение 1,2 г габапентина в качестве премедикации позволяет достоверно снизить послеоперационную потребность в анальгетиках (Dirks J., 2002).
Двухвалентный катион магния также обладает антиноцицептивными свойствами. Установлено, что болюс- ное внутривенное введение магния в дозе 30 мг/кг с последующей послеоперационной инфузией со скоростью 0,5 г/ч приводит к существенному снижению потребности в анальгетиках у пациенток, перенесших абдоминальную гистерэктомию (Kara H., 2002).
Имеются доказательные данные (Acute Pain Management: Scientific Evidence, 2nd edition, 2005) о том, что пери- операционное назначение габапентина снижает интенсивность послеоперационной боли и потребность в опиоид- ных анальгетиках (доказательства I уровня).
Инфильтрация и орошение краев раны растворами ма
Инфильтрация краев раны МА длительного
Инфильтрация и орошение краев раны растворами ма
Инфильтрация краев раны МА длительного
Длительная инфузия растворов МА в течение 24–48 часов через катетер, установленный в ране, малоэффективна в абдоминальной хирургии, однако способна повысить качество обезболивания и снизить потребность в опио- идных анальгетиках у пациентов, перенесших операции на плечевом суставе, позвоночнике, связочном аппарате коленного сустава, а также после стернотомии (Dowling et al., 2003; White et al., 2003; Bianconi et al., 2003; во всех случаях доказательства II уровня).
Инфузия ропивакаина в зоне забора трансплантата из гребня подвздошной кости обеспечивает более высокое качество обезболивания в раннем послеоперационном периоде по сравнению с внутривенным введением опио- идов, кроме того, существенно снижает интенсивность боли в послеоперационной ране при активных движениях в течение первых 3 месяцев после операции (Blumenthal et al., 2005; доказательства II уровня).
Местные анестетики, используемые для послеоперационной регионарной анальгезии
Использование МА для послеоперационного обезболивания
Местные анестетики, используемые для послеоперационной регионарной анальгезии
Использование МА для послеоперационного обезболивания
В данной ситуации особенно значимым является правильный выбор МА и режимов их дозирования, для того чтобы избежать проявления системных токсических эффектов, присущих данным препаратам. Системная токсич- ность МА проявляется негативным воздействием на ЦНС (судороги, потеря сознания) и функции миокарда (угнете- ние синтеза АТФ в митохондриях, нарушения ритма, прямая депрессия миокарда, асистолия).
Лидокаин из всех МА обладает наиболее выраженным прямым нейротоксическим эффектом (вакуолизация и разрушение мембран нейронов, гибель шванновских клеток), выраженность которого усиливается при удлинении экспозиции (увеличении времени контакта препарата с нервом). Кроме того, низкая способность лидокаина свя- зываться с белками плазмы (64 % по сравнению с 95,6 % бупивакаина и 94 % ропивакаина) обусловливает высокую концентрацию его свободной (несвязанной) фракции, ответственной за системную токсичность. Использование лидокаина в болюсном режиме достаточно быстро приводит к формированию тахифилаксии, что требует увеличе- ния доз препарата.
Бупивакаин и ропивакаин являются МА длительного действия, чаще всего применяемыми для послеоперацион- ной анальгезии. Следует помнить, что бупивакаин — анестетик с наиболее выраженным кардиотоксическим эффек- том, проявляющимся при случайном внутрисосудистом введении препарата. Блокада Nа+-каналов, обусловленная бупивакаином, очень стойкая, что существенно снижает эффективность реанимационных мероприятий при желу- дочковой фибрилляции. Индуцированная ропивакаином миокардиальная депрессия и аритмия менее выражены, чем аналогичный эффект бупивакаина, при этом 10-кратное увеличение концентрации ропивакаина существенно не усиливает его кардиотоксическое действие. В экспериментальных условиях установлено, что ропивакаин пода- вляет синтез АТФ в митохондриях миокарда в меньшей степени, чем бупивакаин.
В целом ропивакаин является примерно на 40 % менее кардиотоксичным и
В целом ропивакаин является примерно на 40 % менее кардиотоксичным и
ЭА при помощи комбинированного введения МА и опиоидов по эффективности достоверно превышает аналь- гетический эффект использования данных препаратов в отдельности (Curatolo M., 1998; доказательства I уровня). Большинство специалистов рекомендует использовать в данной ситуации фентанил, поскольку гидрофильный морфин после эпидурального введения быстро попадает в спинномозговую жидкость, накапливаясь в клинически значимых концентрациях в боковых желудочках головного мозга, что создает реальную опасность угнетения дыха- ния. Кроме того, эпидуральное введение морфина достаточно часто сопровождается возникновением интенсив- ного кожного зуда.
Целесообразность эпидурального введения опиоидов в чистом виде ограничена, в частности, при инъекции данных препаратов в эпидуральное пространство на грудном уровне не выявлено преимуществ перед их си- стемным введением, за исключением некоторого снижения частоты послеоперационных ателектазов (Ballantyne J., 1998; доказательства I уровня). Не было выявлено положительного влияния ЭА опиоидами на скорость восста- новления функции ЖКТ (Jorgensen Н., 2001; доказательства I уровня). Анализ опубликованных работ, соответствую- щих требованиям доказательной медицины, позволяет сделать вывод, что преимущества эпидурального введения опиоидных анальгетиков в абдоминальной хирургии не перевешивают риска осложнений более инвазивного мето- да обезболивания по сравнению с парентеральным назначением аналогичных препаратов (Wheatley R. et al., 2001).




















 Актуальные проблемы социальной психологии
Актуальные проблемы социальной психологии Белки. Функции белка
Белки. Функции белка Фармакоэпидемиология. Виды и структура фармакоэпидемиологических исследований
Фармакоэпидемиология. Виды и структура фармакоэпидемиологических исследований Аномалии родовой деятельности
Аномалии родовой деятельности Лапароскопическая адреналэктомия
Лапароскопическая адреналэктомия Организация скорой и неотложной медицинской помощи
Организация скорой и неотложной медицинской помощи Морфологические и анатомо-топографические аспекты строения головы, шеи, грудной клетки. (Лекция 10)
Морфологические и анатомо-топографические аспекты строения головы, шеи, грудной клетки. (Лекция 10) Общение в условиях конфликта
Общение в условиях конфликта Физиология гуморальной регуляции
Физиология гуморальной регуляции Противоспирохетозные средства
Противоспирохетозные средства Артикуляционная гимнастика (консультация для родителей)
Артикуляционная гимнастика (консультация для родителей) Клиническая психология. Предмет и задачи клинической психологии
Клиническая психология. Предмет и задачи клинической психологии Лечебное питание
Лечебное питание Плановая специфическая имунопрофилактика инфекционных болезней
Плановая специфическая имунопрофилактика инфекционных болезней Малые хирургические манипуляции
Малые хирургические манипуляции Клиническое применение нитровазодилататоров
Клиническое применение нитровазодилататоров Лихорадка неясного генеза
Лихорадка неясного генеза Микробиологическая диагностика инфекционных заболеваний. Микроскопический метод
Микробиологическая диагностика инфекционных заболеваний. Микроскопический метод Дорсопатиялар
Дорсопатиялар Алкогольное опьянение
Алкогольное опьянение Тестостерон. Лекция 9
Тестостерон. Лекция 9 Нервы
Нервы Становлення і розвиток вчення про інфантилізм у вітчизняній і зарубіжній психології
Становлення і розвиток вчення про інфантилізм у вітчизняній і зарубіжній психології Реабилитационные мероприятия при лечении перенесенного ишемического инсульта
Реабилитационные мероприятия при лечении перенесенного ишемического инсульта дет ст. препар
дет ст. препар Клинико-патогенетические особенности развития и течения IRIS-синдрома у иммунодепрессивных больных
Клинико-патогенетические особенности развития и течения IRIS-синдрома у иммунодепрессивных больных Синдром Трисомии Х-хромосомы
Синдром Трисомии Х-хромосомы Геморрой
Геморрой