Содержание
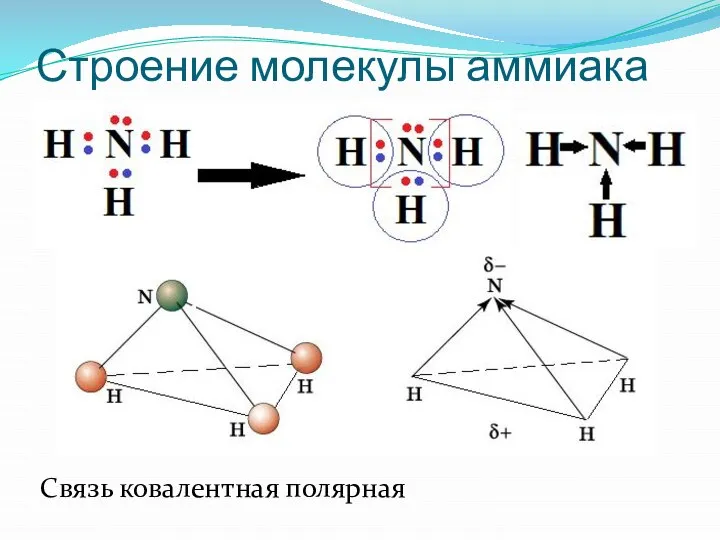
- 3. Строение молекулы аммиака NH3: Связь ковалентная полярная
- 4. Водородная связь – Это химическая связь между атомами водорода одной молекулы и атомами очень электроотрицательных элементов
- 5. Физические свойства аммиака: При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта),
- 6. П О Л У Ч Е Н И Е А ММ И А К А
- 7. Химические свойства аммиака: Реакции с изменением степени окисления атома азота (реакции окисления) NH3 – сильный восстановитель.
- 8. 4. с сильными окислителями 2NH3 + 3Cl2 = N2 + 6HCl (при нагревании) 5. аммиак –
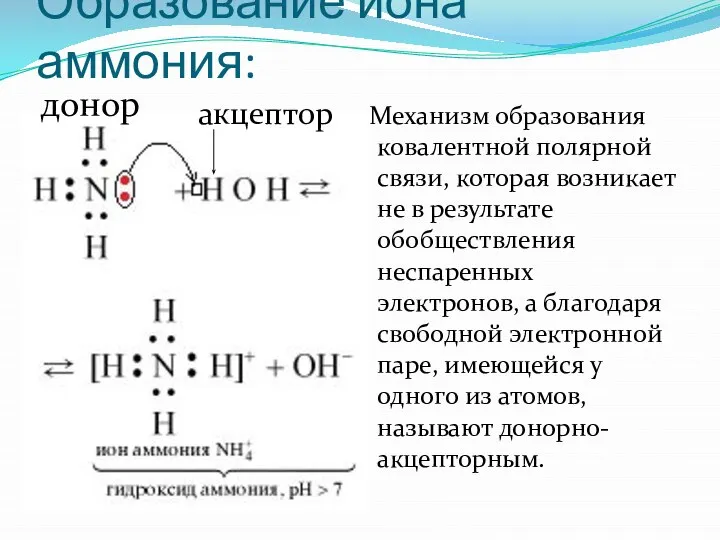
- 9. Образование иона аммония: Механизм образования ковалентной полярной связи, которая возникает не в результате обобществления неспаренных электронов,
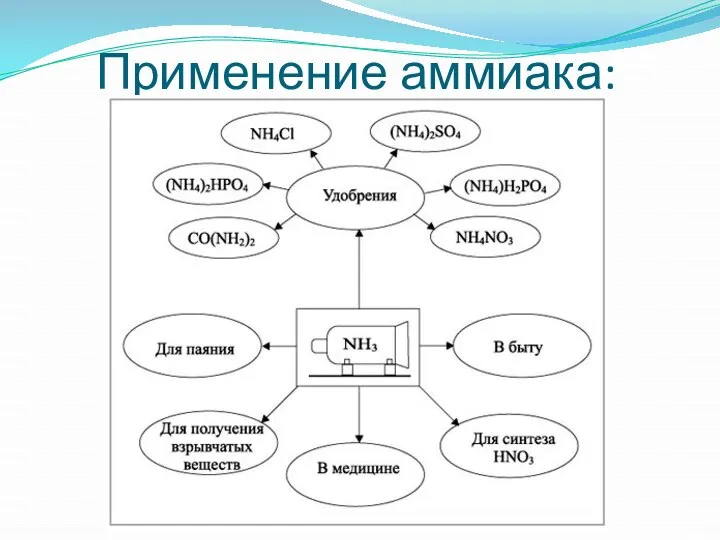
- 10. Применение аммиака:
- 12. Скачать презентацию






 Химический Брейн-ринг. Алканы
Химический Брейн-ринг. Алканы Нитрование целлюлозы
Нитрование целлюлозы Презентация по Химии "Нитраты и организм человека" - скачать смотреть бесплатно_
Презентация по Химии "Нитраты и организм человека" - скачать смотреть бесплатно_ Аминоуксусная кислота
Аминоуксусная кислота Технологические процессы получения кислорода
Технологические процессы получения кислорода Спирты. Физические свойства
Спирты. Физические свойства Рідкісні кристали і полімери. Їх властивості та застосування
Рідкісні кристали і полімери. Їх властивості та застосування Тепловой эффект химических реакций
Тепловой эффект химических реакций Спирты. Классификация спиртов
Спирты. Классификация спиртов Технология лаков и красок
Технология лаков и красок Гелий
Гелий Железо и его соединения
Железо и его соединения Источники углеводородов
Источники углеводородов Основные характеристики различных сортов меда
Основные характеристики различных сортов меда Типы металлоферментов их структурная и функциональная классификация
Типы металлоферментов их структурная и функциональная классификация Реакции терпеноидов. Тема № 4
Реакции терпеноидов. Тема № 4 Electrochemical processes
Electrochemical processes Реакции ионного обмена. Теория химического строения органических соединений. 9 класс
Реакции ионного обмена. Теория химического строения органических соединений. 9 класс Главная подгруппа IV группы
Главная подгруппа IV группы Электролиз
Электролиз Нефть и способы её переработки
Нефть и способы её переработки Презентация по химии Роль Химии в жизни общества
Презентация по химии Роль Химии в жизни общества НЕМЕТАЛЛЫ природные соединения применения продуктов их переработки
НЕМЕТАЛЛЫ природные соединения применения продуктов их переработки d-элементы
d-элементы «Жизнь есть способ существования белковых тел…» (Ф.Энгельс)
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Презентация по Химии "Токсикологическая химия" - скачать смотреть
Презентация по Химии "Токсикологическая химия" - скачать смотреть  Предмет биоорганической химии. Классификация, строение, реакционная способность органических соединений
Предмет биоорганической химии. Классификация, строение, реакционная способность органических соединений Определение активности ферментов
Определение активности ферментов